Resumen 
En Ecuador existen 421 especies de anfibios, lo que lo convierte en el tercer país más diverso del mundo. En la última década esta diversidad se ha visto amenazada, en Ecuador algunos autores reportan la Chytridiomycosis, que es una enfermedad mortal que ataca la piel de los anuros, como una de las posibles causas. Sin embargo en la Región Sur, Loja y Zamora Chinchipe no existen estudios del B. dendrobatidis sobre la declinación de anfibios, es así que este estudio pretende identificar la presencia de agentes patógenos como el B. dendrobatidis.
El análisis de la Chytridiomycosis se realizó en cortes de secciones de piel: parche pélvico y patas a través de rutinas histológicas de cortes transversales de tres micras, teñidas con hematoxilina y eosina; la identificación se realizó en microscopio óptico.
Fueron analizados un total de 62 especimenes de 8 localidades diferentes, ubicadas en Loja y Zamora, los especimenes fueron clasificados en posibles positivos y negativos. Los 12 especimenes posibles positivos fueron llevados al Laboratorio de herpetología de la PUCE, resultando negativos.
Es importante que los 12 especimenes que se sospecha portan la Chytridiomycosis, sean analizados por otros tipos de diagnóstico, como por ejemplo: por otros hongos, envenenamiento por químicos, parásitos, virus, para tratar de determinar otros agentes asociados a la declinación de los anfibios.
Palabras claves: Chytridiomycosis, piel, declinación, Andes
Abstract 
There are 421 amphibian species in Ecuador, which makes the country the third most diverse country in the world. In the last decade, this diversity has been threatened, in Ecuador some authors report Chytridyomicosis, which is a letal illness attacking amphibian skin, as a possible cause. However in the Southern Region, Loja and Zamora Chinchipe there aren´t studies on B. Dendrobatidis about amphibian´s declination, therefore this study is willing to identify the presence of patogen agents as B. Dendrobatidis.
Chytridiomycosis analysis was made by cutting skin sections: pelvic patch and paws by means of histologycal rutins of 3 microns transversal cutting, stained with hematoxiline and eosine; optical microscope was used for identification.
62 specimens from 8 different localities placed in Loja and Zamora were analyzed. Specimens were classified in possible positive and negative ones. Twelve possible positive specimens were taken to PUCE´S Herpetology Laboratory and they resulted negative.
It is remarkable that those 12 specimens suspected to host Chytridiomycosis should be analyzed with other diagnosis types, for example: other fungus, chemical poisoning, parasites, viruses, to try to determine other associated agents to amphibian declination.
Key words: Chytridiomycosis, skin, decline, Andes
Introducción 
Ecuador tiene una densidad de 0.016 especies / Km2, lo que lo hace tres veces mas diverso que Colombia y 21 veces mas que Brasil (Coloma & Quiguango 2000). La información de la ultima década sugiere que al menos 26 especies de anfibios del Ecuador han disminuido (Ron et al. 2000). Las razones para esta crisis de la biodiversidad no son claras. Las declinaciones han ocurrido donde no es evidente la destrucción del hábitat.(Pounds & Crump 1994).
En Ecuador el número de especies desaparecidos es alto, sin embargo por parte de la comunidad científica, la atención prestada es mínima y no existen publicaciones científicas especificas sobre el tema a pesar de que el numero de especies es potencialmente elevado y es comparable al de países como Costa Rica o Panamá en donde han recibido bastante atención. (Pounds & Crump 1994).
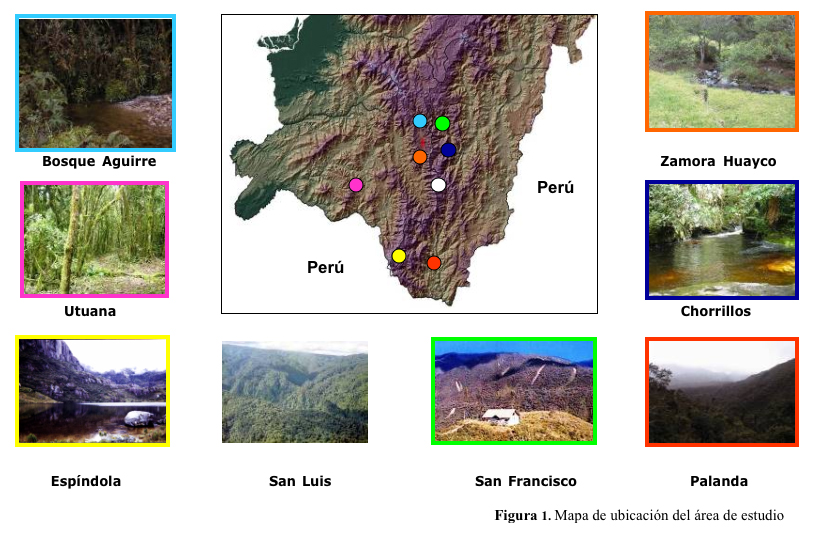
Una de las especies con ejemplo más claro de declinación, es el jambato, Atelopus ignescens (Coloma et al. 2000, Ron et al. 2001), era uno de los sapos más comunes y ampliamente distribuidos en las zonas altas del Ecuador, abarcando las provincias, de Imbabura, Pichincha, Cotopaxi, Napo, Chimborazo y Bolívar. Para la Región Sur del Ecuador, Loja – Zamora Chinchipe, existe evidencia de declinación de anfibios en géneros como: Telmatobius, Atelopus, Bufo; sin embargo no existen estudios para determinar las posibles causas de esta declinación; por esta razón se cree pertinente el estudio de esta enfermedad, para lo cual han sido seleccionadas las siguientes localidades: Bosque Aguirre, San Luis - Parque Nacional Podocarpus (PNP), Palanda, Utuana, Chorrillos, San Francisco, Zamora Huayco, Espíndola - Páramo de Amaluza.
Recientemente se ha identificado al Hongo Quitridio del género Batrachochytrium (Longcore et al. 1999) que infecta a los anfibios y puede haber sido el causante de su muerte en Australia, Sudamérica, América Central y los Estados Unidos (Berger et al. 1998, Pessier et al. 1999, Daszak et al. 1999, Lips 1999). La más común causa de muerte en los anfibios de Australia es el hongo quitridio (Berger et al. 1999) y también ha sido encontrado en menor proporción en anfibios saludables y en renacuajos (Berger et al. 1999).
Chytridyomicosis es considerada una enfermedad infecciosa emergente (Daszak et al. 2000). Los efectos de B. dendrobatidis en algunas poblaciones de anfibios ha sido devastadora, Esta declinación esta siendo investigada por herpetólogos, ecologistas y epidemiólogos.
Siendo así la presente investigación pretende contribuir, considerando la enfermedad mitótica Chytridiomycosis como posible agente causal (Berger et al. 1998, 1999a) Desde el año 1998 en el Museo de la PUCE se iniciaron investigaciones y se han detectado agentes patógenos, siendo así, una especie hace poco descrita de hongo quitridio, Batrachochytrium dendrobatidis (Bd), se cree es la responsable de la extinción de poblaciones y especies de anfibios en el mundo. Este hongo se encuentra en todos los medios de vida, y particularmente en áreas bien conservadas ya que son muy sensibles a la contaminación. Sin embargo, la especie que afecta a los anfibios es de reciente descripción, siendo el primer caso de hongo quitridio que afecta a un vertebrado. (Garner et al. 2005).
Las poblaciones de anfibios afectadas por esta especie de hongo, generalmente desaparecen en pocos meses, siguiendo el patrón de dispersión típico de las enfermedades infecciosas. Los adultos mueren rápidamente mientras que las larvas, que infectan sólo en la zona bucal, mueren más tarde cuando la queratina (y con ella los hongos) se extiende por todo su cuerpo al completar la metamorfosis. Una vez que el hongo ha aparecido en una zona permanece en el medio como saprófito, incluso cuando los anfibios ya han desaparecido. (Garner et al. 2005)
La causa última de la muerte de los animales infectados aún no se conoce con seguridad, pero sí el desarrollo de la enfermedad (conocida como quitridiomicosis), que afecta a la superficie de la piel, y nunca a los órganos internos. Cuando las zooesporas de estos hongos entran en contacto con la piel de los anfibios se fijan, y a los pocos días se desarrollan esporangios que generan nuevas zooesporas. (Garner et al. 2005).
La Chytridiomycosis se diagnosticó en secciones de piel teñidas con técnicas estándar de hematoxilina y eosina (Berger et al. 1999b)
Materiales y Métodos 
Basada en dos fases, detalladas de la siguiente forma:
Fase de Revisión de Información
Secundaria:
Se inició con la revisión del material a ser diagnosticado, es decir con las colecciones de anfibios, obtenidas entre los años 2003 y 2005 por el Blgo. Fernando Nogales, estas colecciones fueron de 8 localidades diferentes, ubicadas en Loja y Zamora Chinchipe. Esta información fue almacenada en una base de datos que contenía la siguiente información básica obtenida en el campo: Localidad, fecha, hora (inicio - final), tiempo de muestreo, Noche, Transecto, Investigadores. E información que describió a los especimenes colectados así: Numero, Familia, Nombre Científico, Altura, Sustrato (hoja, arroyo),Actividad, Observaciones.
Se continuó con la Catalogación y Etiquetación de las colecciones realizadas, así los datos fueron escritos con tinta permanente sobre papel resistente al alcohol, se usó hilo de algodón para atar la etiqueta, la cual fue colocada en la extremidad posterior del espécimen, la información detallada en las etiquetas contenía lo siguiente:
- Número de campo (Designación única de la muestra)
- Iniciales del Colector
- Iniciales del patógeno a ser analizado Batrachochytrium dendrobatidis (BD)
Fase de Laboratorio:
Rutina Histológica E Identificación del hongo
Para realizar el análisis de Batrachochytrium dendrobatidis las colecciones fueron conservadas en frascos con formol al 70%. Se realizó cortes con bisturí de secciones de piel: parche pélvico y patas, las secciones fueron colocadas en cajas plásticas pequeñas utilizadas para procesos histológicos.
Inclusión en Parafina: las muestras de tejidos fueron colocadas en las cajas, se llenaron de parafina, formando un bloque macizo, con el uso del Microtomo a través de rutinas histológicas de cortes transversales de tres micras, se obtuvieron las placas con las muestras de tejido.
Tinción con Hematoxilina y Eosina
Procedimiento de Hematoxilina y Eosina de MAYER (Hall et al. 1993)
Procedimiento de Giemsa (Brown et al. 1993)
Identificación: Se realizó en microscopio óptico.
Resultados 
Análisis para Chytridyomicosis
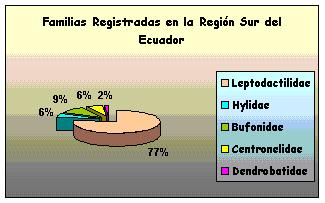
Fueron analizados un total de 62 especimenes. Correspondientes a las siguientes familias: Leptodactilidae con los géneros Eleutherodactulus, Prinophus, Phylionastes; Hylidae con los géneros: Philomedusa e Hyla; Bufonidae con el género: Bufo; Centronelidae con el género Cocranella; y Dendrobatidae con el género: Colosthetus (Fig 1.), encontrados en las 8 localidades diferentes: Bosque Aguirre, San Luis - Parque Nacional Podocarpus (PNP), Palanda, Utuana, Chorrillos, San Francisco, Zamora Huayco, Espíndola - Páramo de Amaluza. ubicadas en Loja y Zamora, (Fig. 2.)
Los resultados fueron clasificados en posibles positivos y negativos. Resultando como negativos 50 especimenes (Anexo 1.) y como posibles positivos 12 especimenes los cuales fueron llevados al Laboratorio de herpetología de la PUCE, resultando negativos para Chytridiomycosis. (Tabla 1.)
Discusión 
Las declinaciones en las poblaciones de anfibios han involucrado también a varias especies de las zonas altas de los Andes del Ecuador (Coloma 1992, 1995, 1996; Vial & Sailor 1993, Stebbins & Cohen 1995, Lotters 1996, Coloma et al. 2000).
Cabe resaltar que según el estudio realizado sobre Chytridiomycosis para el Ecuador, la distribución de especimenes positivos en ese estudio, abarca desde el Páramo del Volcán Chiles en la Provincia de Carchi, al norte, hasta las lagunas del Parque Nacional Cajas, al Sur. (Ron & Merino-Viteri 2000) Es importante considerar que la colección mas antigua para Chytridiomycosis es de Atelopus bomolochos recolectado el 1 de diciembre de 1980, mientras que el mas reciente corresponde a Gastrotheca pseustes colectados como renacuajos el 8 de septiembre de 1999 y metamorfosearon en condiciones de laboratorio. (Merino- Viteri 2001).
Sin embargo es importante tomar en cuenta que según los resultados obtenidos, los 12 especimenes sospechosos para Chytridiomycosis (Tabla. 1), Presentan anormalidades comparativas a una piel sana; como es el caso del Número BD 00021, Eleutherodactylus,
No. BD 00066, Bufo, que presentan desprendimiento en la piel y formación de bulbos, así mismo en el resto de placas se presentan características anormales en la piel, las cuales fueron apreciadas en el microcopio (Fig. 3 A. B. C:) Por la tanto el diagnostico de estos especimenes, debe ser considerado para otros tipos de diagnósticos, como por ejemplo por otros hongos, bacterias, envenenamiento por químicos, etc., para tratar de determinar otros agentes asociados a la declinación de los anfibios.
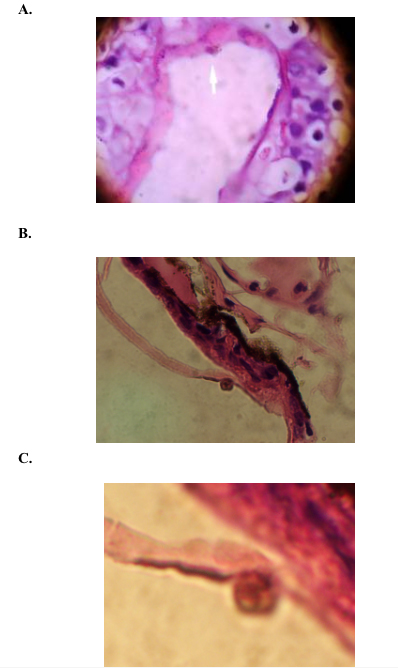
Figura 3. A. Fotografía de la piel de un anfibio Número BD
00021, Eleutherodactylus, presenta estructuras diferentes
observadas a la de una piel normal, B. Fotografía
de la piel de un anfibio No. BD 00066, Bufo, presenta
desprendimiento de la piel y formación de un bulbo. C. Fotografía B usando lente de mayor aumento. Fotos: Diana Freire
A pesar de que los especimenes que resultaron positivos para Chytridiomycosis fueron los obtenidos en museos de historia natural, o colecciones obtenidas entre los años 80 y 90, se consideró de suma importancia realizar un estudio de contribución en la Región Sur, en donde existe evidencias de declinación de Anfibios en las poblaciones de Atelopus, Bufo y Telmatobius, sin embargo no existe mayor atención y escasa información al respecto.
Probablemente ésta enfermedad exista en otras localidades, en tanto no se podría afirmar su ausencia, más bien se deberían realizar más investigaciones tomando en cuenta las enfermedades patógenas y diversos causas.
Cabe resaltar que entre otras, las causas asociadas a la declinación de anfibios son las siguientes: cambio climático, radiación ultravioleta, especies introducidas, uso de agroquímicos, y la citada en la presente investigación en lo que se refiere a enfermedades patógenas, posiblemente estas podrían dar como resultado un proceso de SINERGISMO, en donde la interacción de todos estos patrones podrían estar provocando un aumento drástico en la declinación de anfibios.
Conclusiones 
Existe evidencia que el hongo Batrachochytrium dendrobatidis, esta presente en el Ecuador desde los años 80. Y que esta asociado en las declinaciones de Anfibios en Sudamérica y en todo el mundo.
Los 50 especimenes colectados para el análisis de B. dendrobatidis, en las 8 localidades estudiadas, fueron diagnosticados como negativos para la Chytridiomycosis.
Se encontraron estructuras anormales a las de la piel normal de un anfibio como: desprendimiento, formación de bulbos.
Posiblemente pueden existir la enfermedad en otras localidades, por lo que para confirmar se deben realizar mas investigaciones.
RECOMENDACIONES
Se recomienda la recolección de especimenes de museos para analizar el B. dendrobatidis, y su posible vinculo con las declinaciones en los géneros: Atelopus, Telmatobius, Hyla.
También se recomienda que según los resultados obtenidos, los especimenes sean analizados tomando en cuenta la posible infección por otros hongos, bacterias o diferentes agentes patógenos.
Es importante revisar las tinciones especificas para investigaciones realizadas para hongos, esto facilitara el trabajo al momento de la identificación.
Se debería fomentar el interés por parte de la comunidad científica y la comunidad en general sobre la declinación de anfibios, que es un problema que va en aumento.
Además ya que se observo la venta libre de rana toro en la ciudad de Loja, se debería considerar para controlar a través de los organismos encargados la prohibición de estos.
Agradecimientos 
Un Agradecimiento especial al Blgo. Fernando Nogales por los conocimientos impartidos, auspicio económico y facilitar los especimenes para el análisis del B. dendrobatidis.
A Don Church – Conservación Internacional
A P. Barrazueta por la valiosa colaboración en la etapa de Laboratorio
A Dr. R. Saa por la colaboración en la fase de diagnóstico
Blgo. Juan Pablo Suárez por la colaboración para el material fotográfico
A A. Merino-Viteri por compartir su experiencia en el estudio de B. dendrobatidis
Referencias 
Berger, L., R. Speare, P. Daszak, D.E. Green, A.A. Cunningham, C.L. Goggin, R. Slocombe, M.A. Ragan, A.D. Hyatt, K.P., McDonald, H.B. Hines, K.R., Lips, G. Marantelli & H. Parkes 1998. Chytridiomycosis causes amphibian mortality associated with population declines in the rain forests of Australia and Central America. Proceedings of the National Academy of Science, USA. 95: 9031-9036.
Berger, L., R. Speare & A. Hyatt 1999a. Chytrid fungy and amphibian declines: overview. Implications and future directions. In: A. Campbell (ed.) Declines and Disappearances of Australian Frogs. Enviroment Australia. Canberra Australia, Pp. 21-31.
Berger, L., R. Speare & A. Kent. 1999b. Diagnosis of Chytridiomycosis in amphibians by histologic examination. (Online). Amphibian Disseases Home Page, Australia. http://www.jcu.edu.au/school/phtm/PHTM/frogs/histo/chhisto.htm
Brown, A.B. & L. Febiger .1993. Hematology: Principles and Procedures, Sixth Edition, Philadelphia p101.
Coloma, L. 1992. Reporte no publicado. Anfibios del Ecuador: Estatus poblacional y de Conservación. Pontificia Universidad Católica del Ecuador. Quito, Ecuador
Coloma, L. 1995. Ecuadorian frogs of the genus Colostethus (Anura: Dendrobatidae) Miscellaneous Publication of the Natural History Museum University of Kansas No. 87
Coloma, L. 1996. Systematics, morphology and relationships of Atelopus (Anura: Bufonidae) Pp: 47 in Program notes and abstracts of the 39th Annual Meeting of the Society for the Study of Amphibians and Reptiles. The University of Kansas.U.S.A.
Coloma, L.A., S. Lotters & A.W. Salas. 2000. Taxonomy of the Atelopus ignescens complex (Anura: Bufonidae): designation of a neotype of Atelopus ignescens and recognition of Atelopus exiguous. Herpetológica 56(3): 303 - 324
Coloma, L.A. & A. Quiguango. 2000.Anfibios de Ecuador: Lista de Especies y Distribución altitudinal. (en línea). Museo de Zoología, Pontificia Universidad Católica del Ecuador. Quito, Ecuador. http://www.puce.edu.ec/Zoologia/anfecua.htm
Daszak P., L. Berger, AA. Cunningham, A.D. Hyatt, D.E. Green & R. Speare. 1999. Emerging infectious diseases and amphibian population declines. Emerging infectious diseases 5 (5).
Daszak P., L. Berger, AA. Cunningham, A.D. Hyatt, D.E. Green & R. Speare. 2000.
Emerging infectious diseases and amphibian population declines. Emerging infectious diseases 5: 1-25.
Garner T.W.J., S. Walker, J. Bosch, A.D. Hyatt, A.A. Cunningham & M.C. Fischer 2005. Chytrid fungus in Europe. Emerging Infectious Diseases, Vol. 11, No 10. (en línea) http://www.sosanfibios.org/hongos/html.
Hall, J.A. & T. Achstetter. Métodos Histotecnologicos del AFIP
Lips K. 1999. Mass mortality and population declines of anurans at an upland site in western Panamá. Conserv Biol 13: 117 - 125
Longcore, J.E., AP. Pessier & D.K. Nichols. 1999. Batrachochytrium dendrobatidis gen. Et sp. Nov.,n a chytrid pathogenic to amphibians. Mycologia, 91: 219 – 227
Lotters, S. 1996. The neotropical toad genus Atelopus, Checklist-Biology-Distribution. M. Vences & F. Glaw Verlage, Koln, Alemania
Merini-Viteri, A. 2001. Análisis de posibles causas de las disminuciones de poblaciones de anfibios en los Andes de Ecuador. Licenciatura Thesis, Pontificia Universidad Católica Ecuador, Quito, Ecuador. 66Pgs.
Pessier, A.P.; D.K. Nichols.; J.E. Longcore & M.S. Fuller. 1999. Cutaneous chyridiomicosis in poison dart frogs (Dendrobatides spp.) and White´s tree frogs (Litoria caerulea). Journal of Veterinary Diagnostic Investigation 11: 194-199.
Pounds, J.A. & M.L. Crump. 1994. Amphibian declines and climate disturbance: the case of the golden toad and the harlequin frog. Conservation Biology 8: 72 - 85.
Puschendorf R. Guía práctica para el diagnóstico de quitridiomicosis en anfibios utilizando diferentes técnicas histopatológicas. Apoyado por el Pan – American Studies Institut, un programa confinado por la US National Science Foundation y el US Departament of Energy
Ron, S. R. & A. Merino. 2000. Declinación de anfibios del Ecuador información general y primer reporte de Chytridiomycosis para Sudamerica. Froglog 42: 2-3. Museo de Zoología, PUCE, Quito, Ecuador.
Ron, S.R., L.A. Coloma, A. Merino, J.M. Guayasamín & M. Bustamante. 2000 Información sobre declinaciones de anfibios en el Ecuador. http://www.puce.edu.ec/Zoologia/infodeci.html.
Stebbins, R.C. & N.W. Cohen 1995. A Natural History of Amphibians. Princeton University Press. Estados Unidos.
Vial, J.L. & L. Sailor 1993. The status of amphibian populations. Working document No. 1. Declining amphibian Population Task Force, World Conservation Union. Suiza
4
Anexo 
Tabla 1. Especimenes diagnosticados como posible positivos para Chytridiomycosis, ordenados por Número de Análisis del Batrachochytrium dendrobatides (No. BD)
| No BD | Colección | Familia | Genero | Provincia |
Localidad
|
Altitud (msnm) | Tinción | Resultado | Observaciones |
02 |
09/07/04 |
Leptodactylidae |
Eleutherodactylus |
Loja |
Bosque Aguirre |
2800 |
Hematoxilina |
Negativo |
características anormales |
10 |
09/07/04 |
Leptodactylidae |
Eleutherodactylus |
Loja |
Bosque Aguirre |
2800 |
Hematoxilina |
Negativo |
bulbo |
17 |
29/04/03 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
San Luis |
1220 |
Hematoxilina |
Negativo |
piel desprendida |
21 |
29/04/03 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
San Luis |
1220 |
Hematoxilina |
Negativo |
piel desordenada |
33 |
23/01/05 |
Hylidae |
Philomedusa |
Zamora Chinchipe |
Palanda |
1609 |
Hematoxilina |
Negativo |
bulbo |
ß |
|||||||||
43 |
28/01/05 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Palanda |
1609 . |
Hematoxilina |
Negativo |
características anormales |
49 |
25/01/05 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Palanda |
1609 |
Hematoxilina |
Negativo |
características anormales |
66 |
28/01/05 |
Bufonidae |
Bufo |
Zamora Chinchipe |
Palanda |
1609 |
Hematoxilina |
Negativo |
características anormales |
71 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Utuana |
2340 |
Hematoxilina |
Negativo |
piel desprendida |
|
83 |
12/12/04 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Chorrillos |
1840 |
Hematoxilina |
Negativo |
características anormales |
93 |
29/04/03 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
San Luis PNP |
1220 |
Hematoxilina |
Negativo |
piel desprendida |
94 |
30/04/03 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
San Luis PNP |
1220 |
Hematoxilina |
Negativo |
características anormales |
ANEXOS:
Anexo 1. Total de especies colectados entre los años 2003 y 2005 para el análisis de B. Dendrobatidis
Observaciones: Para verificar y aprovechar el material colectado en el campo se tomó en cuenta especimenes obtenidos en el Bosque Colorado - Puyango y también obtenidos en tiendas de mascotas de la localidad de Loja.
| No Indi- viduo | No BD | Familia | Genero | Provincia |
Localidad
|
Altitud | Tincion | Resultado |
1 |
1 |
Leptodactylidae |
Eleutherodactylus |
Loja |
Bosque Aguirre |
2800 msnm |
Hematoxilina & Eosina |
Negativo |
2 |
2 |
Leptodactylidae |
Eleutherodactylus |
Loja |
Bosque Aguirre |
2800 msnm |
Hematoxilina & Eosina |
Negativo |
3 |
4 |
Leptodactylidae |
Eleutherodactylus |
Loja |
Bosque Aguirre |
2800msnm |
Hematoxilina & Eosina |
Negativo |
4 |
5 |
Leptodactylidae |
Eleutherodactylus |
Loja |
Bosque Aguirre |
2800 msnm |
Hematoxilina & Eosina |
Negativo |
5 |
6 |
Leptodactylidae |
Eleutherodactylus |
Loja |
Bosque Aguirre |
2800 msnm |
Hematoxilina & Eosina |
Negativo |
6 |
8 |
Leptodactylidae |
Eleutherodactylus |
Loja |
Bosque Aguirre |
2800 msnm |
Gram |
Negativo |
7 |
9 |
Leptodactylidae |
Eleutherodactylus |
Loja |
Bosque Aguirre |
2800 msnm |
Hematoxilina & Eosina |
Negativo |
8 |
10 |
Leptodactylidae |
Eleutherodactylus |
Loja |
Bosque Aguirre |
2800 msnm |
Hematoxilina & Eosina |
Negativo |
9 |
11 |
Leptodactylidae |
Eleutherodactylus |
Loja |
Bosque Aguirre |
2800 msnm |
Hematoxilina & Eosina |
Negativo |
10 |
14 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
San Luis |
1220 msnm |
Hematoxilina & Eosina |
Negativo |
11 |
16 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
San Luis |
1220 msnm |
Hematoxilina & Eosina |
Negativo |
12 |
17 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
San Luis |
1220 msnm |
Hematoxilina & Eosina |
Negativo |
13 |
21 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
San Luis |
1220 msnm |
Hematoxilina & Eosina |
Negativo |
14 |
22 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
San Luis |
1220 msnm |
Hematoxilina & Eosina |
Negativo |
15 |
24 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
San Luis |
1220 msnm |
Hematoxilina & Eosina |
Negativo |
16 |
28 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Palanda |
1609 msnm |
Hematoxilina & Eosina |
Negativo |
17 |
33 |
Hylidae |
Philomedusa |
Zamora Chinchipe |
Palanda |
1609 msnm |
Hematoxilina & Eosina |
Negativo |
18 |
42 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Palanda |
1609 msnm |
Hematoxilina & Eosina |
Negativo |
19 |
43 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Palanda |
1609 msnm |
Hematoxilina & Eosina |
Negativo |
20 |
45 |
Bufonidae |
Bufo |
Zamora Chinchipe |
Palanda |
1609 msnm |
Hematoxilina & Eosina |
Negativo |
21 |
49 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Palanda |
1609 msnm |
Hematoxilina & Eosina |
Negativo |
22 |
54 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Palanda |
1609 msnm |
Hematoxilina & Eosina |
Negativo |
23 |
55 |
Hylidae |
Philomedusa |
Zamora Chinchipe |
Palanda |
1609 msnm |
Giemsa, Gram, Hematoxilina |
Negativo |
24 |
57 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Palanda |
1609 msnm |
Hematoxilina & Eosina |
Negativo |
25 |
58 |
Centrolenidae |
Cocranella |
Zamora Chinchipe |
Palanda |
1609 msnm |
Hematoxilina & Eosina |
Negativo |
26 |
62 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Palanda |
1609 msnm |
Hematoxilina & Eosina |
Negativo |
27 |
65 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Palanda |
1609 msnm |
Hematoxilina & Eosina |
Negativo |
28 |
66 |
Bufonidae |
Bufo |
Zamora Chinchipe |
Palanda |
1609 msnm |
Hematoxilina & Eosina |
Negativo |
29 |
69 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Utuana |
2340 msnm |
Hematoxilina & Eosina |
Negativo |
30 |
70 |
Leptodactylidae |
Phrinopus |
Zamora Chinchipe |
Utuana |
2340msnm |
Hematoxilina & Eosina |
Negativo |
31 |
71 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Utuana |
2340msnm |
Hematoxilina & Eosina |
Negativo |
32 |
74 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Utuana |
2340msnm |
Hematoxilina & Eosina |
Negativo |
33 |
75 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Utuana |
2340 msnm |
Hematoxilina & Eosina |
Negativo |
34 |
76 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Chorrillos |
1840 msnm |
Hematoxilina & Eosina |
Negativo |
35 |
77 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Chorrillos |
1840 msnm |
Hematoxilina & Eosina |
Negativo |
36 |
78 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Chorrillos |
1840 msnm |
Hematoxilina & Eosina |
Negativo |
37 |
81 |
Centrolenidae |
Cocranella |
Zamora Chinchipe |
Chorrillos |
1840 msnm |
Hematoxilina & Eosina |
Negativo |
38 |
82 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Chorrillos |
1840 msnm |
Hematoxilina & Eosina |
Negativo |
39 |
83 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Chorrillos |
1840 msnm |
Hematoxilina & Eosina |
Negativo |
40 |
86 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Chorrillos |
1840 msnm |
Hematoxilina & Eosina |
Negativo |
41 |
88 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
Chorrillos |
1840 msnm |
Hematoxilina & Eosina |
Negativo |
42 |
93 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
San Luis PNP |
1220msnm |
Hematoxilina & Eosina |
Negativo |
43 |
94 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
San Luis PNP |
1220msnm |
Hematoxilina & Eosina |
Negativo |
44 |
95 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
San Luis PNP |
1220msnm |
Hematoxilina & Eosina |
Negativo |
45 |
96 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
San Luis PNP |
1220msnm |
Hematoxilina & Eosina |
Negativo |
46 |
98 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
San Francisco |
2160msnm |
Hematoxilina & Eosina |
Negativo |
47 |
99 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
San Francisco |
2160msnm |
Hematoxilina & Eosina |
Negativo |
48 |
00100 |
Leptodactylidae |
Eleutherodactylus |
Zamora Chinchipe |
San Francisco |
2160msnm |
Hematoxilina & Eosina |
Negativo |
49 |
00101 |
Bufonidae |
Bufo |
Loja |
Zamora Huayco |
3220 msnm |
Hematoxilina & Eosina |
Negativo |
50 |
00103 |
Bufonidae |
Bufo |
Loja |
Zamora Huayco |
3220msnm |
Hematoxilina & Eosina |
Negativo |
51 |
00104 |
Leptodactylidae |
Eleutherodactylus |
Loja |
Zamora Huayco |
3220msnm |
Hematoxilina & Eosina |
Negativo |
52 |
00105 |
Dendrobatidae |
Colosthetus |
Puyango |
Bosque El Colorado |
1800 msnm |
Hematoxilina & Eosina |
Negativo |
53 |
00106 |
Leptodactylidae |
Eleutherodactylus |
Puyango |
Bosque El Colorado |
1800 msnm |
Hematoxilina & Eosina |
Negativo |
54 |
00107 |
Hylidae |
Hyla |
Puyango |
Bosque El Colorado |
1800 msnm |
Hematoxilina & Eosina |
Negativo |
55 |
00108 |
Hylidae |
Hyla |
Puyango |
Bosque El Colorado |
1800 msnm |
Hematoxilina & Eosina |
Negativo |
56 |
00109 |
Leptodactylidae |
Eleutherodactylus |
Loja |
Páramo de Amaluza |
3480 msnm |
Hematoxilina & Eosina |
Negativo |
57 |
00110 |
Leptodactylidae |
Eleutherodactylus |
Loja |
Páramo de Amaluza |
3480 msnm |
Hematoxilina & Eosina |
Negativo |
58 |
00111 |
Leptodactylidae |
Eleutherodactylus |
Loja |
Páramo de Amaluza |
3480 msnm |
Hematoxilina & Eosina |
Negativo |
59 |
00112 |
Centrolenidae |
Cocranella |
Loja |
Loja |
2063 msnm |
Hematoxilina & Eosina |
Negativo |
60 |
00113 |
Centrolenidae |
Cocranella |
Loja |
Loja |
2063 msnm |
Hematoxilina & Eosina |
Negativo |
61 |
00114 |
Bufonidae |
Bufo |
Loja |
Loja |
2063 msnm |
Hematoxilina & Eosina |
Negativo |
62 |
00115 |
Bufonidae |
Bufo |
Loja |
Loja |
2063 msnm |
Hematoxilina & Eosina |
Negativo |
11