Resumen 
Se realizó una caracterización abiótica
de ecosistemas acuáticos en la Biorreserva del Cóndor a
través de información secundaria. Posteriormente, se
ejecutó un trabajo de validación a escala local,
incluyendo datos biológicos y físico-químicos,
de los macrohábitats correspondientes a la cota altitudinal de
3200 y 4000 m. Para esto se escogieron 15 puntos de muestreo, 13 en
la zona de Oyacachi y dos en Muertepungu. Los datos obtenidos
mostraron que el trabajo de caracterización abiótica,
en general, diferencia pobremente la variabilidad existente de
ecosistemas acuáticos para el rango altitudinal estudiado. Sin
embargo, se encontraron ciertas tendencias de agrupamiento entre los
puntos de muestreo, por lo que se sugieren algunas variables a tomar
en cuenta como son: la geología, fuentes de agua y niveles de
intervención para mejorar la caracterización abiótica
existente.
Palabras clave: abundancia, ríos, intervención,
riqueza, similitud.
Abstract 
The abiotic characterisations of freshwater ecosystems
were carried out in the Cóndor Bioreserve. All information was
gathered through out of secondary information. Forward local
validation surveys were done including biological and
physico-chemical variables of the macrohabitats belonging to
altitudinal range between 3200 and 4000 m. In this way, 15 sample
units were chosen 13 in Oyacachi and two in Muertepungu area. The
data obtained showed that de work gathering, in general were poorly
differentiates the existent variability of freshwater ecosystems in
the altitude rage studied. However, some tendencies of similarity
clustering between sample units were found, therefore, some variables
such as geology, water springs and perturbation levels were suggested
to be examined to improve the existent abiotic characterisation.
Keywords: abundance, rivers, perturbation, richness,
similitude.
Introducción 
El Presente estudio tiene como meta realizar una validación parcial de los resultados obtenidos durante el proceso de caracterización abiótica de los ecosistemas acuáticos de la Biorreserva del Cóndor, realizado por Vásconez et al. (2002). Los datos obtenidos para esta caracterización abiótica fueron tomados a partir de información secundaria, generada por el proyecto "Conservación del Oso Andino" de EcoCiencia y datos hidrológicos generados por el INAMHI, motivo por el cual, se consideró importante contar con información primaria obtenida en el campo. Este proceso de análisis se basó en la propuesta desarrollada por varios estudios llevados a cabo por el "Freshwater Initiative Aquatic Ecology Team" de los Estados Unidos. En estos estudios se parte de la utilización de variables abióticas, dentro de un sistema de información geográfico (SIG), a fin de desarrollar una clasificación preliminar de ecosistemas acuáticos, que sirva como herramienta de manejo y como línea base para un mapeo y estudio de la biodiversidad acuática en un contexto Ecorregional o, en este caso, para un paisaje funcional Higgins et al. (1998). Sin embargo, en Vásconez et al. (2002), esta propuesta fue modificada en algunos aspectos debido a que la disponibilidad de información, así como, las condiciones y la dinámica de los ecosistemas acuáticos del Ecuador son diferentes a los de países de zonas templadas.
El trabajo previo que presenta Vásconez et al. (2002) cuenta con información de base, en la cual, se presentan los lineamientos de clasificación a una escala de paisaje. De aquí que este nivel de análisis deba ser complementado o respaldado con información biológica de los ecosistemas acuáticos que conforman la zona de estudio y que, a su vez, genere información a una escala local y regional Hawkins et al.(2000). Estudios realizados en ecosistemas acuáticos de las zonas de páramo en el Ecuador Jacobsen & Terneus (2001); Terneus (2002). demuestran la importancia de estos ecosistemas en términos de riqueza y diversidad de flora acuática. De igual manera, estudios realizados en los páramos del Volcán Chiles, Hare & Ramsay (2001); Prowse (2001); Weaver & Rundle (2001) resaltan la importancia de los macroinvertebrados acuáticos como indicadores de la salud de estos ecosistemas. Existe información adicional que considera los factores de variación altitudinal y las condiciones abióticas del ambiente donde se desarrollan los organismos acuáticos Jacobsen et al. (1997); Jacobsen & Encalada (1998) como elementos que definen los patrones de estructura, composición y distribución de las especies que se desarrollan en estos ambientes. Todos estos trabajos, proporcionan insumos que darán sustento al presente estudio.
Este proyecto pretende integrar la información biótica y abiótica generada y establecer similitudes entre los ambientes acuáticos objetos de estudio. Con esta base, se pretende confrontar estos ambientes acuáticos, con los distintos niveles de intervención humana que pudiere tener la zona de estudio. Al final, se intenta iniciar el proceso de identificación de especies potenciales, que podrían ser utilizadas como bioindicadores de calidad ambiental, permitiendo, a mediano plazo, generar un índice de calidad de agua para los ecosistemas acuáticos de los páramos del Ecuador.
Materiales y Métodos 
Área de estudio
El presente estudio se realizó en dos cuencas distintas. La primera corresponde a las cabeceras del río Oyacachi, en un rango altitudinal entre 3200 y 4000 m, y un área total de 187.5 Km2. La segunda corresponde a la cuenca que alimenta la Laguna de Muertepungu, en la zona del Antisana, en un rango altitudinal entre 3900 y 4200 m, y un área total de 7.5 Km2.
Oyacachi: La cuenca del Río Oyacachi, tiene una pendiente oeste-este que va desde más de 4000 m, en el nacimiento de este río en los páramos, hasta los 1800 m en la unión con el Río Santa María.
La Comunidad de Oyacachi, se encuentra en este valle y está ubicada a 40 km al Este de Quito, pertenece a la Provincia de Napo, está situada dentro de los límites de la Reserva Ecológica Cayambe-Coca, en la ribera del río Oyacachi a 3200 m y cubre un área aproximada de 445 km2 DIVA (2000). Esta comunidad tiene aproximadamente 600 habitantes Cuesta et al.(2003). Las ocupaciones principales son la agricultura y la ganadería. La tala de madera y la cría de truchas son también actividades importantes.
Muertepungu: La Laguna de Muertepungu se encuentra en la cordillera oriental de los Andes a 4000 m de altitud, se ubica al Sureste de la Parroquia de Píntag, en el cantón Quito, en la Provincia de Pichincha. La formación de esta laguna, así como de las lagunas de Secas, Marco Quingray y Tipo Pugru, está relacionada con la emisión de lava volcánica conocida como "flujo de lava de Antisanilla", la cual bloqueó la salida del agua por su posición de relleno en uno de los drenajes principales de la zona. La Laguna de Muertepungu se formó al inicio del derrame lávico. El flujo ocupó un valle glaciar a lo largo de 11 km FUNAN (1999).
El relieve es irregular y escarpado en el sector del flujo de lava de Antisanilla, e irregular con pendientes desde 45% en la parte alta y pequeños valles cerca de las lagunas. El sector del "Flujo de lava de Antisanilla" colinda con la Reserva Ecológica Antisana. Esta área cumple un papel muy importante en la supervivencia del Cóndor Andino. Además, funciona como un filtro para el agua que viene desde las lagunas superiores hacia Píntag FUNAN (1999).
A los 4000 m se encuentran los terrenos de la Asociación Pecuaria Santa Rosa de Muerte pungu, cuya extensión abarca aproximadamente 600 ha. La Asociación dispone de 200 cabezas de ganado de carne. No hay control sobre el pastoreo de ganado, las quemas periódicas y la pesca. En particular, en el sector de las lagunas de Secas, no se ha reglamentado el desarrollo de los criaderos de truchas, ni de los asentimientos precarios de los concesionarios de canteras FUNAN (1999).
Selección de puntos de muestreo
Se tomaron datos bióticos y abióticos en 15 puntos de muestreo, los mismos que se seleccionaron en función de la variación de cotas altitudinales, de los clusters 14 y 16 (grupos de macrohábitats) establecidos en Vásconez et al. (2002) y posibles sitios de intervención humana. De estos puntos, 13 corresponden a la cuenca del Río Oyacachi, y dos a la cuenca que alimenta la Laguna de Muertepungu, en la zona del Antisana ([[Tabla 1]]).
Los dos puntos elegidos en la zona del Antisana, que no corresponden al análisis de cluster generado por Vásconez et al. (2002), fueron considerados porque brindarán información adicional, como testigos de comparación espacial, en relación con la zona de Oyacachi. Además, generarán información base para la ejecución del plan de manejo de la zona de Muertepungu.
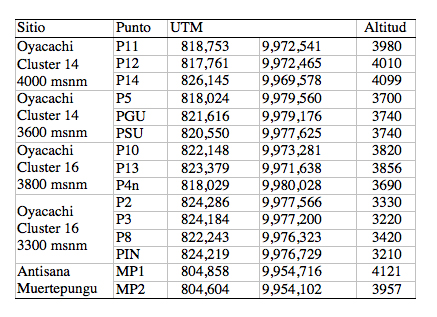
Tabla 1.
Localización geográfica de los puntos de
muestreo en las cuencas de Oyacachi y Muertepungu
Las coordenadas geográficas UTM corresponden a la Zona 17, Datum Provisional para Sudamérica de 1956. Los puntos están ordenados según los clusters y las cotas altitudinales.
Table 1. Geographic location of sampled sides in Oyacachi and Muertepungu water sheets
The geographic coordinates UTM belong to the 17 zone, Provisional datum from South America of 1956. The dots are ordered according to the clusters and altitudinal patterns.
Las coordenadas geográficas UTM corresponden a la Zona 17, Datum Provisional para Sudamérica de 1956. Los puntos están ordenados según los clusters y las cotas altitudinales.
Table 1. Geographic location of sampled sides in Oyacachi and Muertepungu water sheets
The geographic coordinates UTM belong to the 17 zone, Provisional datum from South America of 1956. The dots are ordered according to the clusters and altitudinal patterns.
De los 15 puntos de muestreo, cuatro se ubicaron en sitios correspondientes a la cota altitudinal de 3200 - 3400 m, formando parte del cluster 16. Seis puntos de muestreo se ubicaron en la cota altitudinal correspondiente a los 3600 - 3800 m, formando parte de los cluster 14 y 16. De los cinco últimos puntos, tres corresponden al cluster 14 y dos a Muertepungu, los mismos que se ubicaron en cotas altitudinales próximas a los 4000 m incluidos los puntos de Muertepungu ([[Tabla 1]]).
Recopilación de datos
En cada punto de muestreo se recopilaron tanto datos físico - químicos como biológicos:
Parámetros Físico -
Químicos
Concentración y saturación de oxígeno *;pH (Potencial hidrógeno) *;Conductividad eléctrica *; Temperatura del agua *; Alcalinidad (medición en el laboratorio por titulación) *;Caudal y velocidad de corriente (método de dilución de NaCl) *; Caracterización física del substrato. (tres transectos a lo ancho del río con al menos 60 puntos de identificación del substrato presente en el lecho del río.); Pendiente del cauce (desnivel del espejo de agua en una distancia de 20 m).
*Para la medición de la mayoría de estos parámetros se utilizó un equipo Hydrolab Quanta.
Componente biológico
Se consideraron los grupos de plantas acuáticas y macroinvertebrados.
lantas Acuáticas
Para determinar la riqueza y composición de especies en los 15 puntos de muestreo se utilizaron transectos de profundidad en línea Terneus (2002), los mismos que estuvieron ubicados a lo ancho del río y fueron divididos en subunidades de 1m x 1m. Dentro de cada subunidad de muestreo se identificó el número de especies presentes y sus formas de vida.
Para medir los cambios que podrían ocurrir en las comunidades de plantas acuáticas con relación al tiempo y por factores de intervención humana, en cada subunidad de muestreo, se realizó un análisis de estructura. Para esto se estimó porcentualmente la abundancia y cobertura de las especies presentes dentro de cada subunidad.
Adicionalmente, se efectuaron registros cualitativos en algunos segmentos de río para complementar la información sobre la composición florística de la vegetación acuática en cada río. Las muestras fueron colectadas y preservadas en una solución de alcohol al 50% para su posterior identificación en el herbario QCA de la Universidad Católica.
Macroinvertebrados
Por estandarización, se eligieron puntos de muestreo con características físicas similares en caudal y composición del substrato, en zonas de rápidos con una profundidad máxima de 40 cm. Esto debido a que los rápidos son hábitats con una diversidad más grande de organismos Allan (1996).
En estos puntos, se tomaron 12 submuestras del bentos, utilizando el sistema Surber (cuantitativas respecto a superficie, 200 cm2), en tres transectos de cuatro submuestras, a 0%, 25%, 50% y 75% del ancho del río. Además, se tomo una muestra de otros microhábitats existentes, utilizando la red D (cuantitativa respecto a tiempo, tres minutos). Las muestras fueron conservadas en alcohol etílico (>90%) para su posterior limpieza e identificación en laboratorios de la Universidad San Francisco de Quito. La limpieza de las muestras se realizó a simple vista. Su identificación, al nivel más fino posible, se realizó utilizando estéreo microscopios y las claves de Roldán (1996) y Fernández & Domínguez (2001).
Análisis de datos
Para el análisis de datos se aplicó estadística no paramétrica para definir tendencias en el comportamiento de los datos. Se usaron técnicas de agrupamiento utilizando índices de similitud para identificar grupos afines de microcuencas tanto en condiciones bióticas como abióticas Legendre & Vaudor (1991). Se aplicaron los índices de Sorensen para identificar ríos similares en la composición de especies y Steinhaus para identificar ríos similares en abundancias tanto de plantas como de macroinvertebrados Kent & Coker (1992). Al final, se integró toda la información ecológica aplicando un análisis canónico de correspondencias ter Braak & Smilauer (1986), con la finalidad de visualizar en contexto cual es el comportamiento de los datos, integrando en un solo análisis las relaciones entre variables bióticas, abióticas y puntos de muestreo.
Adicionalmente, se aplicó la formula del modelo de Michaelis - Menten Stryer (1985); Vásconez (2000) para estimar las taxa potenciales de macroinvertebrados presentes en los puntos de muestreo, así como para verificar la eficiencia del esfuerzo de muestreo realizado. Además, se emplearon los índices matemáticos de riqueza de Fisher-, de diversidad de Shannon-Wieners (H') y de equilibrio Pielou (J) Mangurran (1988); Rosenzweig (1995), para caracterizar a los ecosistemas acuáticos estudiados respecto a los parámetros mencionados y, conjuntamente con los índices biológicos EPT, ASPT Metcalfe (1989) y ASPI, para determinar su calidad ambiental y el grado de intervención en los mismos. El índice ASPI, utilizado en este documento, es una modificación realizada en el cálculo del índice ASPT para ponderar la abundancia de la taxa encontrada, con el fin de tener una apreciación más fina de las características de los ríos estudiados.
Resultados 
Componente abiótico
Dentro de las variables abióticas analizadas, existen mayores diferencias en los valores de conductividad y alcalinidad en los ríos (P12, P13, P8 y Pin). El pH fue otra variable que presentó una variación considerable (7.30 - 8.21) entre todos los puntos de muestreo ([[Tablas 2a y 2b]]).
El análisis de similitud de variables abióticas (Figura 1) separa a los ríos en tres grupos. El primero está compuesto por dos ríos alrededor de la cota de los 4000 m, El segundo incluye a los ríos alrededor de la cota de los 3700 m, a uno de los ríos de la cota de 4000 m y a los dos ríos de la zona de Muertepungu. El tercer grupo está compuesto por los ríos alrededor de la cota de los 3300 m, En general, hay un patrón cuya tendencia tiene relación con la altitud (Figura 1).
Componente biótico
Plantas acuáticas
Se registró un total de 29 especies entre monocotiledoneas, dicotiledóneas, helechos y musgos, de las cuales 20 especies fueron tolerantes y tan solo nueve propiamente acuáticas. La forma de vida predominante fue la enraizada emergente con 13 especies, seguida por las enraizadas sumergidas con nueve especies y las enraizadas flotantes con siete especies. Las especies que registraron la mayor abundancia y cobertura fueron Gunnera magellanica, Sphagnum sp.1, Cotula minuta y Equisetum bogotense ([[Table 3]]).
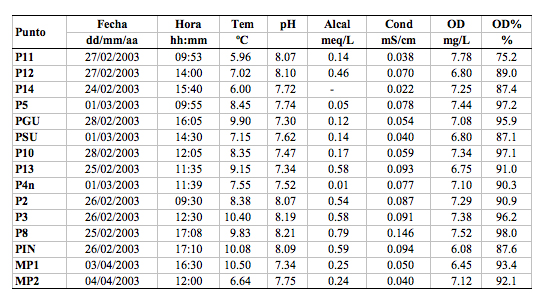
Tabla 2a. Variables
abióticas registradas en los 15 ríos de estudio en las
cuencas del Río Oyacachi y la laguna de Muertepungu.
Donde se detalla: Fecha de colección; Hora de colección; Tem, la temperatura en grados centígrados; pH, el potencial hidrógeno; Alcal, la alcalinidad, en miliequivalentes por litro; Cond, la conductividad eléctrica en mili siemens por centímetro; OD, la concentración de oxígeno en miligramos por litro; OD%, la saturación de oxígeno en porcentaje.
Table 2a. Abiotic variables recorded on the 15 rivers studied in the Oyacachi water sheet and Muertepungu Lake.
Were detailed: Collection data, Collection time; Tem, temperature in Celsius; pH, hydrogen potential; Alcal, alkalinity, in miniequivalent per litter; Cond, Conductivity in mili siemens per centimetre; OD, Oxygen concentration in milligrams per litter; OD%, the percentage of oxygen saturation.
Donde se detalla: Fecha de colección; Hora de colección; Tem, la temperatura en grados centígrados; pH, el potencial hidrógeno; Alcal, la alcalinidad, en miliequivalentes por litro; Cond, la conductividad eléctrica en mili siemens por centímetro; OD, la concentración de oxígeno en miligramos por litro; OD%, la saturación de oxígeno en porcentaje.
Table 2a. Abiotic variables recorded on the 15 rivers studied in the Oyacachi water sheet and Muertepungu Lake.
Were detailed: Collection data, Collection time; Tem, temperature in Celsius; pH, hydrogen potential; Alcal, alkalinity, in miniequivalent per litter; Cond, Conductivity in mili siemens per centimetre; OD, Oxygen concentration in milligrams per litter; OD%, the percentage of oxygen saturation.
Los patrones de distribución de las plantas acuáticas, en la gradiente altitudinal del estudio, fueron amplios. La mayoría de las especies se encontraron en al menos 12 de los 15 ríos muestreados. El análisis de similitud de distribución agrupa cuatro tipos de ríos, similares en su composición florística (Figura 2). Uno de los puntos de Muertepungu (MP1) registra una composición florística diferente.
Los patrones de abundancia y cobertura de las plantas acuáticas de los ríos estudiados, fueron similares (Figura 3). El dendrograma muestra la formación de cuatro grupos de ríos similares. Sin embargo, es importante resaltar que existe una división en dos grupos a un nivel superior.
Macroinvertebrados acuáticos
Se colectó un total de 13268 macroinvertebrados correspondientes a 36 especies agrupadas en cinco clases: (Oligochaeta, Hirudinea, Insecta, Arachnoidea y Bivalvia) y 18 morfotipos que podrían ser nuevas especies. Los grupos más abundantes fueron los Chironomidae, seguidos por Baetidae y por Leptoceridae ([[Tabla 4]]).
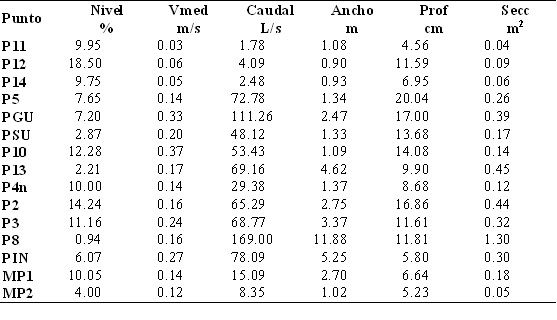
Tabla 2b. Variables
abióticas registradas en los 15 puntos de muestreo en las
cuencas del Río Oyacachi y la laguna de Muertepungu. Donde
se detalla: Nivel, la pendiente del espejo de agua en el tramo de río
estudiado, en porcentaje; Vmed, la velocidad media de la corriente,
en metros por segundo; Caudal, el caudal en litros por segundo;
Ancho, el ancho promedio en metros; Prof, la profundidad media en
centímetros; Secc, la sección promedio de los ríos
estudiados, en metros cuadrados.
Table 2b. Abiotic variables recorded in 15 sampled sides in the water sheets of Oyacachi River and Muertepungu Lake. Were detailed: Topography level, the shallow water slope within the river studied, represented in percentage value; Vmed, The water speed overage, in meters per second; The water flow in litters per second; The weight river in meters; The depth overage in centimetres; Secc, The shape overage of the rivers studied, in square meters.
Table 2b. Abiotic variables recorded in 15 sampled sides in the water sheets of Oyacachi River and Muertepungu Lake. Were detailed: Topography level, the shallow water slope within the river studied, represented in percentage value; Vmed, The water speed overage, in meters per second; The water flow in litters per second; The weight river in meters; The depth overage in centimetres; Secc, The shape overage of the rivers studied, in square meters.
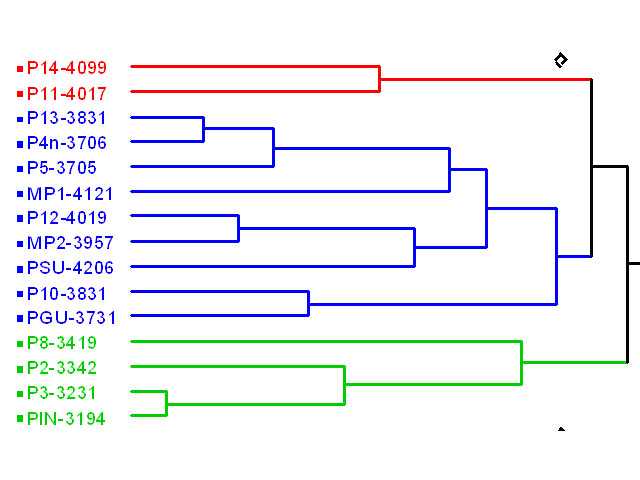
Figura 1. Análisis
de similitud de variables abióticas registradas en los 15
puntos de muestreo de las cuencas de Oyacachi y Muertepungu.
Análisis de similitud basado en distancias euclidianas. En este caso la separación de los ríos tiene relación con la variación altitudinal como un factor que incluye variaciones en otros parámetros como la cantidad de oxígeno disuelto y su saturación y la dinámica de los ambientes por su relieve.
Figure 1. Similarity analysis of abiotic variables register in 15 sampled sides of Oyacachi and Muertepungu water sheets.
Similarity analysis based on Euclidian distances. In this case the rivers split is according with altitudinal variation as a factor, which include extra parameters like, dissolve oxygen concentration, their saturation and the environment dynamic.
Análisis de similitud basado en distancias euclidianas. En este caso la separación de los ríos tiene relación con la variación altitudinal como un factor que incluye variaciones en otros parámetros como la cantidad de oxígeno disuelto y su saturación y la dinámica de los ambientes por su relieve.
Figure 1. Similarity analysis of abiotic variables register in 15 sampled sides of Oyacachi and Muertepungu water sheets.
Similarity analysis based on Euclidian distances. In this case the rivers split is according with altitudinal variation as a factor, which include extra parameters like, dissolve oxygen concentration, their saturation and the environment dynamic.
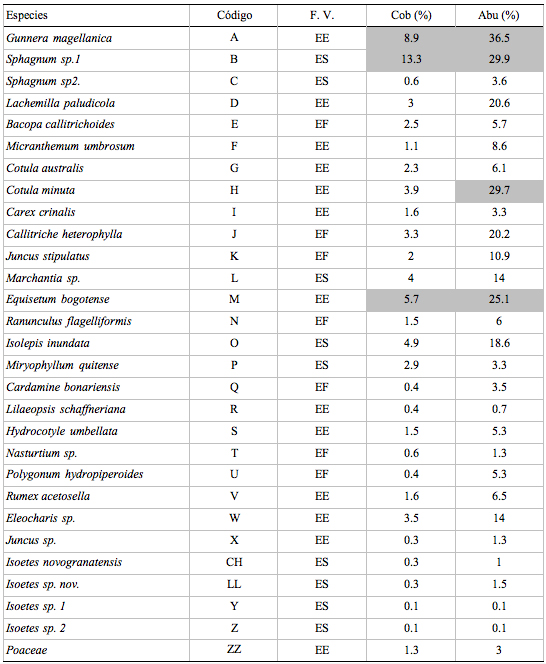
Tabla 3. Composición
florística, formas de vida y estructura de las plantas
acuáticas registradas en el estudio.
Donde se detalla: F.V., Forma de vida (EE= enraizada emergente; ES= enraizada sumergida; EF= enraizada flotante); Cob (%),Cobertura relativa; Abu (%), Abundancia Relativa.
Table 3. Floristic composition, life forms and structure of the aquatic plants communities recorded throw the study.
Were detailed: F.V., Life form (EE= Emergent rooted; ES= Submersed rooted; EF= Floating rooted); Cob (%), Relative cover; Abu (%), Relative Abundance.
Donde se detalla: F.V., Forma de vida (EE= enraizada emergente; ES= enraizada sumergida; EF= enraizada flotante); Cob (%),Cobertura relativa; Abu (%), Abundancia Relativa.
Table 3. Floristic composition, life forms and structure of the aquatic plants communities recorded throw the study.
Were detailed: F.V., Life form (EE= Emergent rooted; ES= Submersed rooted; EF= Floating rooted); Cob (%), Relative cover; Abu (%), Relative Abundance.
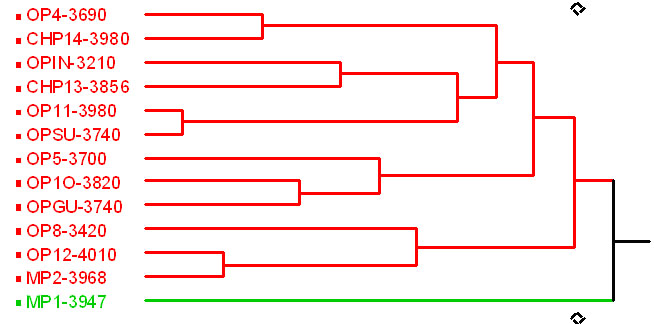
Figura 2. Análisis
de Similitud de la distribución de plantas acuáticas
registrada en 13 puntos de muestreo.
Basado en el Índice de Similitud: Sorensen (S8), con un valor de correlación pearson: 0.79. La separación del punto MP1 se manifiesta por la presencia de dos especies de Isoetaceae que no se encuentran en los ríos anteriores, lo que demuestra el buen estado de salud de los ambientes acuáticos en Muertepungu. Figure 2. Similarity index of aquatic plants distribution recorded in 13 sampled sides
Based on Sorensen (S8) similarity index: The Pearson correlation value: 0.79. The split of MP1 sampled side express by the presence of two species of Isoetaceae, which do not exist in previous rivers. It means the good quality of aquatic environments in Muertepungu.
Basado en el Índice de Similitud: Sorensen (S8), con un valor de correlación pearson: 0.79. La separación del punto MP1 se manifiesta por la presencia de dos especies de Isoetaceae que no se encuentran en los ríos anteriores, lo que demuestra el buen estado de salud de los ambientes acuáticos en Muertepungu. Figure 2. Similarity index of aquatic plants distribution recorded in 13 sampled sides
Based on Sorensen (S8) similarity index: The Pearson correlation value: 0.79. The split of MP1 sampled side express by the presence of two species of Isoetaceae, which do not exist in previous rivers. It means the good quality of aquatic environments in Muertepungu.
Figura
3. Análisis de similitud de la abundancia y cobertura
de plantas acuáticas registrada en 13 puntos de muestreo
Basado en el Índice de Similitud: Steinhaus: (S17), con un valor de correlación Pearson: 0.82.
En este caso a pesar de existir dos grupos de ríos diferentes, estos no muestran un patrón de definición muy claro respecto a variables de altitud, intervención o físico-quimica del agua. Se sugiere entonces que los patrones de cobertura y abundancia en las plantas acuáticas de los ríos muestreados son similares.
Figure 3. Similarity index of covert and abundance patterns of aquatic plants recorded in 13 sampled sides.
Based on Steinhaus (S17) similarity index: The Pearson correlation value of 0.82. In this case there are two groups of different rivers; however those do not show definition patterns related with altitude, human impacts or water Physio- quemestry. There fore it suggest the covert and abundance patterns of aquatic plants in the sampled rivers are similar.
Basado en el Índice de Similitud: Steinhaus: (S17), con un valor de correlación Pearson: 0.82.
En este caso a pesar de existir dos grupos de ríos diferentes, estos no muestran un patrón de definición muy claro respecto a variables de altitud, intervención o físico-quimica del agua. Se sugiere entonces que los patrones de cobertura y abundancia en las plantas acuáticas de los ríos muestreados son similares.
Figure 3. Similarity index of covert and abundance patterns of aquatic plants recorded in 13 sampled sides.
Based on Steinhaus (S17) similarity index: The Pearson correlation value of 0.82. In this case there are two groups of different rivers; however those do not show definition patterns related with altitude, human impacts or water Physio- quemestry. There fore it suggest the covert and abundance patterns of aquatic plants in the sampled rivers are similar.
El análisis de similitud de distribución de macroinvertebrados (Figura 4) muestra una separación inicial en tres grupos. El primer grupo incluye los ríos de Muertepungu, separados de cuatro ríos de la cota de 3700 m de Oyacachi. El segundo grupo, incluye dos ríos de la cota de 4000 msnm y tres ríos de la cota de 3300 m, El último grupo contiene ríos de todo el rango altitudinal.
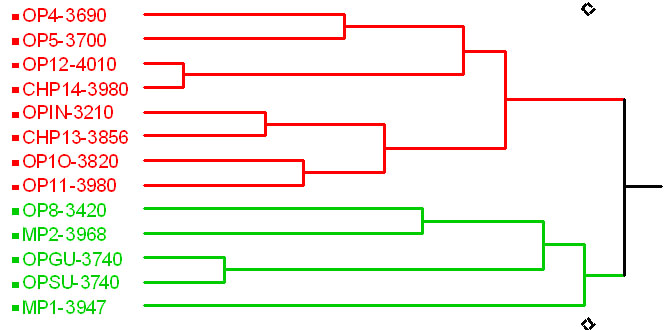
El análisis de similitud de los patrones de abundancia de macroinvertebrados (Figura 5) igualmente muestra una separación inicial en tres grupos de ríos. Los dos primeros contienen los ríos de Muertepungu y los de Oyacachi, de las cotas 4000 m y la mayoría de 3800 m y uno de la cota de 3300 m, El tercer grupo, contiene casi todos los ríos de la cota de 3300 msnm y uno de la cota superior.
La [[Tabla 5]] tiene una taxa esperada (Vm) con un promedio de 29 grupos y en su mayoría están incluidas en un rango entre 22 y 35 taxa. Es interesante destacar los altos valores de los ríos 12, 10 y 3, pertenecientes cada uno a una cota diferente establecida en el modelo experimental planteado. En la [[Tabla 5]] también son interesantes los resultados en los ríos 14, Gu y 2, pertenecientes cada uno a una cota diferente. En estos ríos, se necesita un esfuerzo de colección más amplio. Estos ríos tienen una alta variedad de microhábitats y/o contienen taxa con bajo número de individuos, difíciles de colectar.
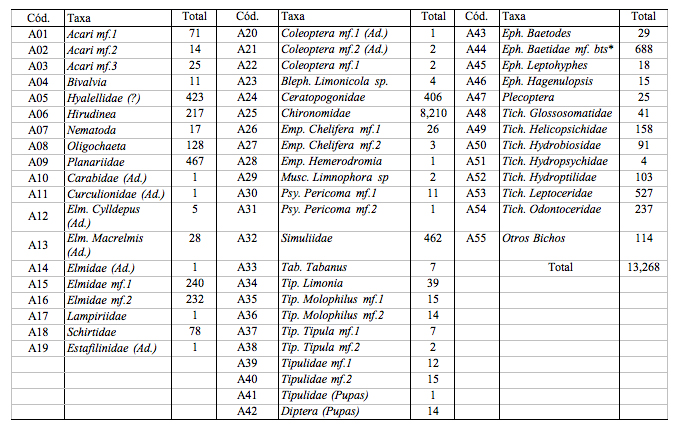
Tabla
4.- Composición, abundancia y estadios de desarrollo de los
macroinvertebrados colectados en los 15 puntos de muestreo en las
cuencas de Oyacachi y Muertepungu
Donde se detalla: Cód., Código de los taxa, Taxa, enumeración de los distintos taxa; mf., denota el morfotipo; (?) duda sobre la identificación; (Ad.), adultos; mf.bts*, se refiere a los individuos de la familia Baetidae que corresponderían al antiguo género Baetis Roldán (1996), ahora separado en distintos géneros Fernández & Rodríguez (2001). En esta tabla se incluyen los taxa colectados tanto con el sistema Surber como con la Red "D". También se incluyen totales para cada taxon.
Table 4. Composition, abundance and growing stage of the Macroinvertebrates collected in 15 sampled sides in the Oyacachi and Muertepungu water sheets.
Were detailed: Cod., Taxon code; Taxa., Taxon numeration; mf., morphotype; (?)., uncertainly identification; (Ad.), adults; mf.bts*, Baetidae Family members which belong to the oldest genus Bateéis Roldán (1996), now split in a different genus Fernández & Rodríguez (2001). In this table include the taxa were collected with surber and "D" net. Also included the overall values for each taxon.
Donde se detalla: Cód., Código de los taxa, Taxa, enumeración de los distintos taxa; mf., denota el morfotipo; (?) duda sobre la identificación; (Ad.), adultos; mf.bts*, se refiere a los individuos de la familia Baetidae que corresponderían al antiguo género Baetis Roldán (1996), ahora separado en distintos géneros Fernández & Rodríguez (2001). En esta tabla se incluyen los taxa colectados tanto con el sistema Surber como con la Red "D". También se incluyen totales para cada taxon.
Table 4. Composition, abundance and growing stage of the Macroinvertebrates collected in 15 sampled sides in the Oyacachi and Muertepungu water sheets.
Were detailed: Cod., Taxon code; Taxa., Taxon numeration; mf., morphotype; (?)., uncertainly identification; (Ad.), adults; mf.bts*, Baetidae Family members which belong to the oldest genus Bateéis Roldán (1996), now split in a different genus Fernández & Rodríguez (2001). In this table include the taxa were collected with surber and "D" net. Also included the overall values for each taxon.
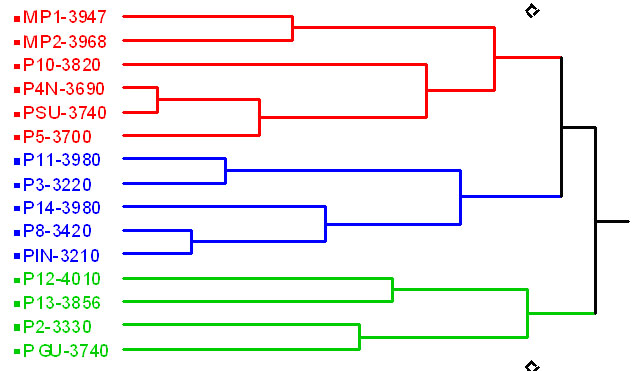
Figura 4. Análisis
de similitud de distribución de macroinvertebrados acuáticos
registrada en los 15 ríos estudiados.
Basado en el Índice de Similitud: Sorensen (S8), con un valor de correlación Pearson: 0.47. En el análisis se observa tres grupos que presentan diferentes distribuciones en la taxa de macroinvertebrados. Sin embargo, dentro de cada grupo, la variación altitudinal es muy amplia por lo que no se tiene un patrón de distribución de macroinvertebrados claramente definido.
Figure 4. Similarity index of aquatic macroinvertebrates distribution recorded in 15 studied rivers.
Based on Sorensen (S8) similarity index: the Pearson correlation value of 0.47. The analysis shows three groups, which present different distribution patterns in the macroinvertebrate taxa. However, within each group the altitudinal variation is high. There fore the macroinvertebrate distribution patterns are not defined.
Basado en el Índice de Similitud: Sorensen (S8), con un valor de correlación Pearson: 0.47. En el análisis se observa tres grupos que presentan diferentes distribuciones en la taxa de macroinvertebrados. Sin embargo, dentro de cada grupo, la variación altitudinal es muy amplia por lo que no se tiene un patrón de distribución de macroinvertebrados claramente definido.
Figure 4. Similarity index of aquatic macroinvertebrates distribution recorded in 15 studied rivers.
Based on Sorensen (S8) similarity index: the Pearson correlation value of 0.47. The analysis shows three groups, which present different distribution patterns in the macroinvertebrate taxa. However, within each group the altitudinal variation is high. There fore the macroinvertebrate distribution patterns are not defined.
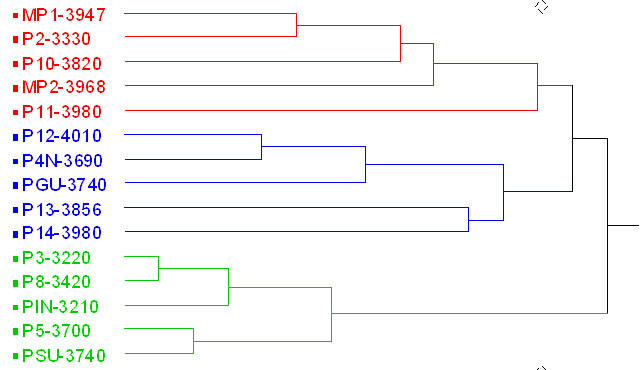
Figura 5. Análisis
de similitud de abundancias de macroinvertebrados acuáticos
registrada en los 15 puntos de muestreo.
Basado en el Índice de Similitud: Steinhaus (S17), con un valor de correlación Pearson: 0.81.
En la separación de grupos, se observa ciertas tendencias por los niveles de intervención, lo cual está definiendo la formación de grupos similares en la abundancia de macroinvertebrados.
Figure 5. The similarity analysis of aquatic macroinvertebrates abundance recorded in the 15 sampled sides.
Based on Steinhaus (S17) similarity index: the Pearson correlation value of 0.81. The split groups show tendencies by human impact, which define the similarity groups of macroinvertebrates abundances.
Basado en el Índice de Similitud: Steinhaus (S17), con un valor de correlación Pearson: 0.81.
En la separación de grupos, se observa ciertas tendencias por los niveles de intervención, lo cual está definiendo la formación de grupos similares en la abundancia de macroinvertebrados.
Figure 5. The similarity analysis of aquatic macroinvertebrates abundance recorded in the 15 sampled sides.
Based on Steinhaus (S17) similarity index: the Pearson correlation value of 0.81. The split groups show tendencies by human impact, which define the similarity groups of macroinvertebrates abundances.
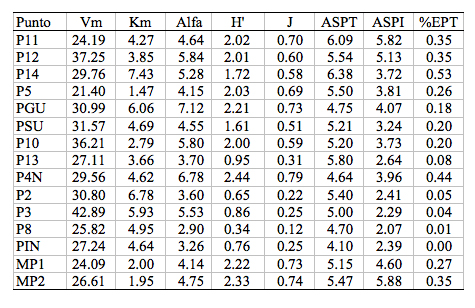
Tabla 5. Resultado
de índices matemáticos y bióticos en los 15 ríos
de estudio de las cuencas del Río Oyacachi y la Laguna de
Muertepungu.
Donde se detalla: Vm, número de taxa estimadas presentes en los ríos estudiados (Vm, fórmula de Michaelis-Menten); Km, número de submuestras necesarias para colectar la mitad de la taxa estimadas, presentes en los ríos estudiados (Km, fórmula de Michaelis-Menten); Alfa, valor del índice de riqueza Fishe-; H', valor del índice de diversidad Shannon-Wieners; J, valor del índice de equilibrio de Pielou; ASPT, valor de este índice; ASPI, valor del índice ASPT ponderado con relación al número de individuos colectados. %EPT, porcentaje de los órdenes Ephemeroptera, Plecoptera y Treichoptera, respecto al total de individuos colectados.
Table 5. The mathematic and biotic index results gathered in the 15 sampled sides in the water sheets of Oyacachi River and Muertepungu Lake.
Were detailed: Vm, The taxa predicted within the rivers studied (Vm, formula of Michaelis-Menten); Km, Sub samples number required to collect a half of predicted sampled within the rivers (Km, formula of Michaelis-Menten); Alfa, The richness index value Fishe-; H', The diversity index value Shannon-Wieners; J, The balance index value of Pielou; ASPT, this index value; ASPI, The value index of ponder ASPT related with collected specimens. %EPT, Orders percentage of Ephemeroptera, Plecoptera and Treichoptera, related with a total of specimens collected.
Donde se detalla: Vm, número de taxa estimadas presentes en los ríos estudiados (Vm, fórmula de Michaelis-Menten); Km, número de submuestras necesarias para colectar la mitad de la taxa estimadas, presentes en los ríos estudiados (Km, fórmula de Michaelis-Menten); Alfa, valor del índice de riqueza Fishe-; H', valor del índice de diversidad Shannon-Wieners; J, valor del índice de equilibrio de Pielou; ASPT, valor de este índice; ASPI, valor del índice ASPT ponderado con relación al número de individuos colectados. %EPT, porcentaje de los órdenes Ephemeroptera, Plecoptera y Treichoptera, respecto al total de individuos colectados.
Table 5. The mathematic and biotic index results gathered in the 15 sampled sides in the water sheets of Oyacachi River and Muertepungu Lake.
Were detailed: Vm, The taxa predicted within the rivers studied (Vm, formula of Michaelis-Menten); Km, Sub samples number required to collect a half of predicted sampled within the rivers (Km, formula of Michaelis-Menten); Alfa, The richness index value Fishe-; H', The diversity index value Shannon-Wieners; J, The balance index value of Pielou; ASPT, this index value; ASPI, The value index of ponder ASPT related with collected specimens. %EPT, Orders percentage of Ephemeroptera, Plecoptera and Treichoptera, related with a total of specimens collected.
Los valores del índice ASTP ([[Tabla 5]]) muestran que los ríos estudiados tienen una buena calidad ambiental, si se los compara con los valores determinados por Vásconez (2000). Se observa además, que el río IN, es uno de los que tienen los valores más bajos. El índices ASPI, mucho más sensible que el anterior, hace una discriminación más fina de los ríos con relación a su calidad ambiental. Obsérvense los bajos valores obtenidos, en el río 13 (cota 3700 msnm) y en los ríos correspondientes a la cota de los 3300 m, El índice EPT ([[Tabla 5]]) discrimina a los ríos en el mismo sentido que el índice ASPI, confirmando la existencia de un deterioro ambiental en los ríos mencionados.
Patrones ecológicos
Plantas Acuáticas
El análisis canónico de correspondencias (CCA) integra los factores ecológicos principales que inciden en los patrones de distribución y composición de las plantas acuáticas. El análisis muestra que las variables de temperatura del agua, caudal, pH, conductividad eléctrica y tipo de substrato, están definiendo los patrones antes mencionados (Figura 6). De acuerdo a la influencia de estas variables, se observa que la disposición de los ríos P10, P11, P12 y P13 están mayormente influenciados por las variaciones de pH y temperatura del agua, lo que los hace, a su vez, similares en su composición florística. Por otro lado, los ríos M2, P8, SU y P14 conforman otro grupo que está mayormente influenciado por las variaciones del caudal, lo que los hace similares entre sí en su composición florística. Existe un tercer grupo que está integrado por los ríos P4 y P5, los mismos que están influenciados por las variaciones en la conductividad y el pH del agua. Un último grupo está conformado por los ríos M1, GU e IN, los mismos que están mayormente influenciados por las variaciones en el tipo de substrato. Al final se observa que el punto IN (intervenido) está separado del resto de grupos, mostrando características particulares con relación al resto de ríos (Figura 6).
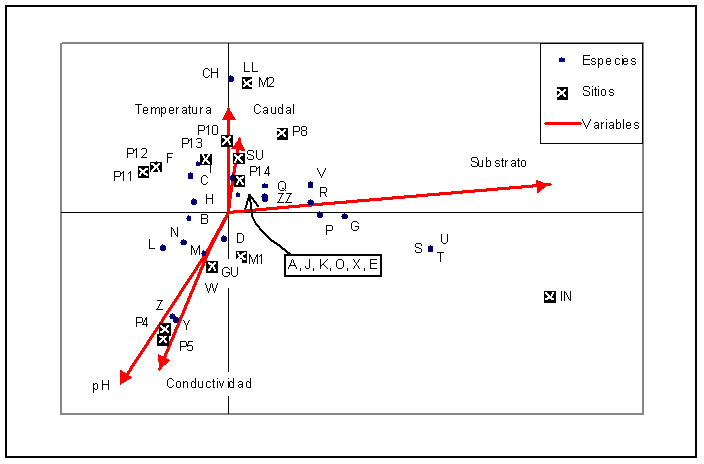
Figura 6. Análisis
Canónico de Correspondencia (CCA) de Plantas Acuáticas
registradas en 13 puntos de muestreo de las dos cuencas de estudio.
Donde se detalla: Los punto de muestreo; Las variables abióticas que inciden en los patrones de distribución y composición de las siguientes plantas acuáticas: A, Gun. mag.; B, Sphag. sp1.; C, Sphag. sp2.; D, Lachem.palu.; E, Bacop.callit.; F, Micrant. umb.; G, Cotu. mex.; H, Cot. min.; I, Carex crin; J, Callit. heter.; K, Juncus stip.; L, Marchantia; M, Equis. bogo.; N, Ranunc. flag.; O, Isol. inun.; P, Miryo. quit.; Q, Carda. bon.; R, Lilaea scil.; S, Hydro.umbel.; T, Nasturtium sp.; U, Polyg. hidrop.; V, Rumex acet.; W, Eleocharis sp.; X, Juncus sp.; Y, Isoe. novog.; Z, Isoe. sp.nov.; CH, Isoe. sp1; LL, Isoe. sp2; ZZ, Poaceae. Los códigos de las plantas acuáticas colectadas en este estudio se encuentran listados en la Tabla III.
Figure 6. Canonical Correspondence Analysis (CCA) of aquatic plants recorded in 13 sampled places of two water sheets studied.
Were detailed: the sampled sides; the abiotic variables which have incidence in the composition and distribution patterns of the following aquatic plants: A, Gun. mag.; B, Sphag. sp1.; C, Sphag. sp2.; D, Lachem.palu.; E, Bacop.callit.; F, Micrant. umb.; G, Cotu. mex.; H, Cot. min.; I, Carex crin; J, Callit. heter.; K, Juncus stip.; L, Marchantia; M, Equis. bogo.; N, Ranunc. flag.; O, Isol. inun.; P, Miryo. quit.; Q, Carda. bon.; R, Lilaea scil.; S, Hydro.umbel.; T, Nasturtium sp.; U, Polyg. hidrop.; V, Rumex acet.; W, Eleocharis sp.; X, Juncus sp.; Y, Isoe. novog.; Z, Isoe. sp.nov.; CH, Isoe. sp1; LL, Isoe. sp2; ZZ, Poaceae. The code of aquatic plants collected in this study had been listed in Table III.
Donde se detalla: Los punto de muestreo; Las variables abióticas que inciden en los patrones de distribución y composición de las siguientes plantas acuáticas: A, Gun. mag.; B, Sphag. sp1.; C, Sphag. sp2.; D, Lachem.palu.; E, Bacop.callit.; F, Micrant. umb.; G, Cotu. mex.; H, Cot. min.; I, Carex crin; J, Callit. heter.; K, Juncus stip.; L, Marchantia; M, Equis. bogo.; N, Ranunc. flag.; O, Isol. inun.; P, Miryo. quit.; Q, Carda. bon.; R, Lilaea scil.; S, Hydro.umbel.; T, Nasturtium sp.; U, Polyg. hidrop.; V, Rumex acet.; W, Eleocharis sp.; X, Juncus sp.; Y, Isoe. novog.; Z, Isoe. sp.nov.; CH, Isoe. sp1; LL, Isoe. sp2; ZZ, Poaceae. Los códigos de las plantas acuáticas colectadas en este estudio se encuentran listados en la Tabla III.
Figure 6. Canonical Correspondence Analysis (CCA) of aquatic plants recorded in 13 sampled places of two water sheets studied.
Were detailed: the sampled sides; the abiotic variables which have incidence in the composition and distribution patterns of the following aquatic plants: A, Gun. mag.; B, Sphag. sp1.; C, Sphag. sp2.; D, Lachem.palu.; E, Bacop.callit.; F, Micrant. umb.; G, Cotu. mex.; H, Cot. min.; I, Carex crin; J, Callit. heter.; K, Juncus stip.; L, Marchantia; M, Equis. bogo.; N, Ranunc. flag.; O, Isol. inun.; P, Miryo. quit.; Q, Carda. bon.; R, Lilaea scil.; S, Hydro.umbel.; T, Nasturtium sp.; U, Polyg. hidrop.; V, Rumex acet.; W, Eleocharis sp.; X, Juncus sp.; Y, Isoe. novog.; Z, Isoe. sp.nov.; CH, Isoe. sp1; LL, Isoe. sp2; ZZ, Poaceae. The code of aquatic plants collected in this study had been listed in Table III.
El análisis canónico de correspondencias también muestra la preferencia de las especies por ocupar ambientes específicos. Se determina que las especies de Isoetes sp.1 (CH), Isoetes sp. 2 (LL), Isoetes nobogranatensis (Z) e Isoetes sp. nov (Y) prefieren crecer en ambientes pobres en nutrientes, muy poco intervenidos y de excelente calidad de agua, como son los ríos P4, P5 y M2. Otros grupos de plantas que muestra preferencias por crecer en ambientes bastante limpios son los helechos musgos y hepáticas como Equisetum bogotense (M), Sphagnum sp. 1 (B), Sphagnum sp. 2 (C) y Marchantia (L). También se pudieron identificar especies como Hydrocotyle umbellata (S), Nasturtium sp. (T) y Polygonum hydropiperoides (U) que prefieren crecer en medios con mayor cantidad de nutrientes y que por consiguiente se encontraron en el río intervenido junto al pueblo de Oyacachi (Figura 6).
Macroinvertebrados
El análisis canónico de correspondencias (CCA) integra los factores ecológicos principales que inciden en los patrones de distribución y composición de los macroinvertebrados. El análisis muestra que las variables de pH, conductividad eléctrica, temperatura del agua, caudal y oxígeno disuelto, están definiendo los patrones antes mencionados (Figura 7). El análisis muestra un grupo de ríos conformados por P2, P3, P13 e IN, cuya variación en la composición y estructura de macroinvertebrados está influenciada por las variaciones en caudal y el porcentaje de saturación de oxígeno disuelto. Otro grupo está conformado por los ríos P5, P14 y GU, los mismos que están influenciados por las variaciones en el pH. El tercer grupo está conformado por los ríos P10, P11, P12 y P4, los mismos que están influenciados por las variaciones en el pH, temperatura y conductividad del agua. Al final se observa que los puntos de Muertepungu (M1 y M2) no guardan relación con los ríos de Oyacachi y se encuentran influenciados fuertemente por las variaciones del pH y la conductividad (Figura 7).
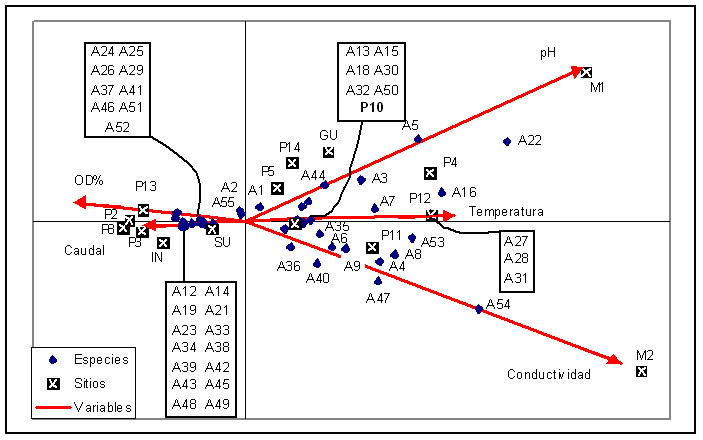
Figura 7. Análisis
Canónico de Correspondencia (CCA) de Macroinvertebrados
Acuáticos colectados en los 15 puntos de muestreo.
Donde se detalla: Los punto de muestreo; Las variables abióticas que inciden en los patrones de distribución y composición de los macroinvertebrados acuáticos encontrados, entre estos: A23, Limonicola spp.; A25, Chironomidae.; A43, Baetodes spp.; A44, Baetidae mf. Baetis; A45, Lepohyphes spp.; A46, Hagenolpsis spp. Los códigos de los macroinvertebrados acuáticos colectados en este estudio se encuentran listados en la Tabla IV.
Figure 7. Canonical Correspondence Analysis (CCA) of aquatic Macroinvertebrates recorded in 15 sampled places.
Were detailed: the sampled sides; the abiotic variables which have incidence in the composition and distribution patterns of the following aquatic Macroinvertebrates: A23, Limonicola spp.; A25, Chironomidae.; A43, Baetodes spp.; A44, Baetidae mf. Baetis; A45, Lepohyphes spp.; A46, Hagenolpsis spp. The code of Macroinvertebrates collected in this study had been listed in Table IV.
Donde se detalla: Los punto de muestreo; Las variables abióticas que inciden en los patrones de distribución y composición de los macroinvertebrados acuáticos encontrados, entre estos: A23, Limonicola spp.; A25, Chironomidae.; A43, Baetodes spp.; A44, Baetidae mf. Baetis; A45, Lepohyphes spp.; A46, Hagenolpsis spp. Los códigos de los macroinvertebrados acuáticos colectados en este estudio se encuentran listados en la Tabla IV.
Figure 7. Canonical Correspondence Analysis (CCA) of aquatic Macroinvertebrates recorded in 15 sampled places.
Were detailed: the sampled sides; the abiotic variables which have incidence in the composition and distribution patterns of the following aquatic Macroinvertebrates: A23, Limonicola spp.; A25, Chironomidae.; A43, Baetodes spp.; A44, Baetidae mf. Baetis; A45, Lepohyphes spp.; A46, Hagenolpsis spp. The code of Macroinvertebrates collected in this study had been listed in Table IV.
El análisis canónico de correspondencia también muestra la preferencia de cierta taxa por ocupar ambientes específicos. Así, por ejemplo, se determina la presencia de Baetodes spp, Lepohyphes spp y Limonicola spp únicamente en la cota alrededor de los 3300 m, mientras que Hagenolpsis spp únicamente sobre la cota del los 3500 m, Así mismo se observa la preferencia de Baetidae morfotipo Baetis y de Odontoceridae por las cotas más altas dentro de este estudio (Figura 9). Existen otros taxa con ciertas tendencias espaciales, sin embargo, la escasa abundancia de algunos de ellos, así como el grado de intervención encontrado en la cota más baja, da cierto sesgo a esta información, por lo que no se la toma en cuenta en este apartado. Finalmente, es importante recalcar la gran abundancia de Chironomidae en los ríos que se considera enriquecidos, natural o artificialmente. Como se observa en el gráfico, todos los ríos enriquecidos y/o con cierto grado de intervención están separados del resto (ríos 2, 3, 8, IN y 13)(Figura 7).
Discusión 
Patrones Abióticos
Las relaciones encontradas entre los ríos, con respecto a las variables abióticas utilizadas en este estudio no concuerdan con las condiciones definidas en la hipótesis de trabajo planteada. Hay una diferenciación, con relación a la altitud, mucho más específica que la establecida en Vásconez et al. (2002). Se podría definir una cota de cambio aproximadamente a los 3500 m, Se observa también la importancia de otros factores, correlacionados en diferente grado a la variable altitud, que influencian los patrones abióticos encontrados. La geología y el régimen hidrológico están entre las principales, teniendo en cuenta las relaciones establecidas respecto a pH, alcalinidad y conductividad eléctrica, así como respecto a substrato, caudal, temperatura y saturación de oxígeno.
Lamentablemente, la intervención humana tiene un papel importante en el área de estudio. Como se muestra en el dendrograma (Figura 1), la diferenciación de ríos en los grupos establecidos puede también estar relacionado con el impacto, por más leve que este sea ([[Tabla 6]]). El primer grupo de ríos corresponde a los ríos más alejados a las zonas de intervención, justamente por su poca accesibilidad. El segundo grupo corresponde a los ríos que tienen un primer nivel de intervención, cruzados por carreteras y por tanto más accesibles. El tercer grupo, extremadamente diferente en sus condiciones ambientales, corresponde a ríos que están ubicados en zonas cercanas a poblados.
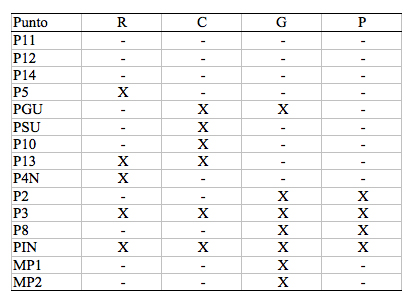
Tabla 6. Distintos
tipos de impacto encontrados en los ríos estudiados de las
cuencas de Oyacachi y Muertepungu
Donde se detalla: (R), Represas; (C), Carreteras; (G), Ganadería; (P) y Población
Table 6. Different kinds of impacts recorded in the sampled rivers of the Oyacachi and Muertepungu water sheets.
Were detailed: (R), Dams; (C), Roads; (G), Livestock; (P) and Population.
Donde se detalla: (R), Represas; (C), Carreteras; (G), Ganadería; (P) y Población
Table 6. Different kinds of impacts recorded in the sampled rivers of the Oyacachi and Muertepungu water sheets.
Were detailed: (R), Dams; (C), Roads; (G), Livestock; (P) and Population.
Patrones Bióticos
Plantas Acuáticas
La similitud encontrada en los patrones de cobertura y abundancia de especies de plantas acuáticas responde, principalmente, al tipo de reproducción asexual que manifiestan las diferentes especies, que en su mayoría, es de tipo vegetativo (rizomas, estolones y yemas abortivas), lo que les permite ocupar espacios vacíos creando una dominancia monoespecífica representada en una forma de crecimiento gregario McCreary (1991); Terneus (2002). Sin embargo, este crecimiento gregario podría resultar afectado por factores externos como los niveles de intervención en las zonas de estudio. Esto provoca que los nutrientes del substrato y las condiciones físico-químicas del agua se modifiquen, ocasionando cambios en los patrones de cobertura y abundancia de plantas acuáticas. Otro de los factores externos que modifica estos patrones es la inestabilidad de los ambientes lóticos, generado por las permanentes fluctuaciones del nivel de agua, lo que dificulta el establecimiento de las plantas acuáticas en las zonas de ribera Vannote et al. (1980).
Frente a esta inestabilidad de hábitats las plantas acuáticas han desarrollado una serie de adaptaciones que les permite resistir estos cambios drásticos de su entorno. Esta podría ser una de las razones para que la forma de vida enraizada emergente domine en la composición de la flora acuática. Por otro lado, la presencia de Isoetes, musgos y hepáticas demuestra que los ecosistemas se encuentran en buen estado ya que estos crecen únicamente en aguas puras y limpias Sculthorpe (1967).
La división en dos grupos a un nivel superior (Figura 3), parece estar definida por niveles de intervención. El primer grupo, está formado por los ríos de Oyacachi que registraron intervención de obras de infraestructura e influencia de centros poblados, a excepción de los puntos 12 y 14 que muestran una similitud estrecha entre sí y que se encuentran separados del grupo. El segundo grupo, está formado por los ríos de Oyacachi y Muertepungu, los mismos que mostraron intervención con relación a actividades agrícolas y ganaderas.
Por otro lado, los patrones de distribución de las plantas acuáticas fueron bastante amplios por lo que no existe una influencia directa de la gradiente altitudinal a esta cota. La separación de uno de los ríos de Muertepungu, podría ser porque es el único río que presentó dos especies de Isoetes que no se encontraron en los demás ríos y que indica el buen estado de sus aguas. En definitiva, la mayoría de ríos comparten especies, lo que indica una fuerte relación con el origen geológico reciente de la cordillera de los Andes Sauer (1965); Steinitz-Kannan et al.(1983).
Al final, el análisis canónico de correspondencias confirma que la composición florística está determinada por los niveles de intervención que presentan los ríos, lo cual se manifiesta en la variación de la composición físico-química del agua y en el tipo de sedimento en el que crecen las plantas acuáticas. Los niveles de intervención mencionados responden a obras de infraestructura como carreteras y represas, lo cual ha creado mayores trastornos en los puntos P4 y P5 y también a actividades agrícolas, piscícolas y asentamientos humanos que han afectado más a los ríos P8, IN, M2 y M1.
La preferencia de hábitats mostrada por algunas especies, principalmente de helechos (Isoetes spp.) y musgos (Sphagnum spp.), pone de manifiesto la importancia de estos grupos como potenciales especies bioindicadoras de calidad ambiental. Sin duda alguna, existen otros factores externos que podrían estar modificando estos patrones, como por ejemplo la geología, que no se tomó en cuenta en este estudio. Esta variable, tiene que ver con algunos elementos físico-químicos del agua, factores relacionados con la composición geológica de la zona. Sin embargo, estas variaciones también pueden ser atribuidas a elementos de intervención.
Macroinvertebrados
Los esquemas de presencia, composición y abundancia de taxa no se ajustan al modelo establecido en Vásconez et al. (2002), al no coincidir con los grupos de macrohábitats establecidos en el trabajo mencionado (Clusters 14 y 16). Además, sí parece existir diferencias, tanto de riqueza como de abundancia de taxa, en relación con la altitud, en el rango altitudinal establecido en el estudio mencionado.
Se han encontrado diferencias entre los ríos alrededor de la cota de los 4000 m, aun cuando todos corresponden al cluster 14 Vásconez et al. (2002). Comparando estos ríos con el resto del grupo de ríos estudiados, existe una tendencia de patrones de mayor riqueza y menor abundancia de macroinvertebrados. Sin embargo, se necesitarían estudiar muchos más ríos para establecerla. La diferencia más marcada, encontrada en el río 12, parece tener relación con la composición geológica de la microcuenca que drena, así como a la posible influencia de un pequeño pantano. La diferencia entre los ríos 11 y 14 puede tener relación con diferencias en condiciones geográficas, tanto ambientales como bióticas, por ejemplo nivel de precipitación, cambios de temperatura, y la vegetación predominante en el área de drenaje, entre otras. Sin embargo, no existe información suficiente para establecer estas relaciones.
También se han encontrado diferencias entre los ríos alrededor de la cota de los 3700 m, Los patrones de similitud establecidos en estos ríos no corresponden a los clusters 14 y 16, definidos en Vásconez et al. (2002). Las similitudes encontradas, apuntan a que la distribución se relaciona con factores como la composición geológica del área de drenaje (ríos 10 y 13; 4 y GU; 5 y SU) e influencias geográficas como régimen hidrológico y climático (en especial ríos 4, 5, SU y GU). También se observa una posible influencia de zonas de pantano (ríos 4, 5, 10 y GU) y diferencias en la vegetación del área de drenaje (río SU).
La relación que mejor se ha definido corresponde a los ríos alrededor de la cota de 3300 m, Lamentablemente, en estos ríos se ha encontrado intervención, por lo que éste puede ser el factor que los aglutina en gran medida. Evidentemente la cercanía entre ellos y, por tanto, la similitud en las condiciones ambientales de éstos, es otro factor de similitud importante. Aún así, se puede destacar la diferencia de los ríos 2 y 8, respecto a los otros. Aparentemente estas diferencias tienen relación con el orden correspondiente a cada río.
El orden de los ríos es un factor determinante que debe ser tomado en cuenta en una caracterización abiótica de ecosistemas acuáticos Allan (1996); Higgins et al. (1998). Se encuentran similitudes entre los ríos 8 y 13 que apuntan en este sentido. Los dos ríos son el resultado de la influencia de muchas áreas de drenaje y, por tanto, representan la suma de estas condiciones. Los dos ríos presentan un enriquecimiento inusual. Por un lado, puede ser justamente el resultado de la acumulación de nutrientes provenientes de algunas cuencas. Por otro lado, se plantea la influencia de otro factor que puede tener gran importancia y que no se tomó en cuenta para este estudio y es la presencia de aguas minerales. La zona de Oyacachi tiene abundantes fuentes minerales que pueden contribuir enormemente con la composición química de las aguas de los ecosistemas acuáticos. Por consiguiente debe ser tomado en cuenta para futuros trabajos en la zona de estudio.
Es necesario recalcar la importancia que puede tener la geología en la zona de estudio. Es interesante encontrar un patrón de mayor abundancia en la zona de los ríos 10 y 13. Probablemente esto tenga relación directa con la geología de las cuencas involucradas, que distan poco entre sí. Un caso similar ya se mencionó respecto a los ríos 11 y 12, también muy próximos entre sí.
Las tendencias encontradas en el análisis canónico de correspondencia (Figura 7) separan a los ríos en dos grandes grupos. Esta separación tiene mucho que ver con la variable altitud, directamente correlacionada con el cambio de temperatura y la saturación de oxígeno, e indirecta en relación con la composición química del agua y el caudal de los ríos. En el primer grupo, compuesto por los ríos de la cota de 3300 m y dos de la de 3700 m, (13 y SU), evidentemente existe un componente de enriquecimiento, al tener la variable saturación de oxígeno gran fuerza en la separación de los ríos. El segundo grupo, compuesto por el resto de ríos, como se esperaba, es separado fuertemente por la variable temperatura. Sin embargo, las variables pH y conductividad presentan gran influencia en la distribución de los ríos (Figura 7). Es decir, que la geología tiene un papel importante en las diferencias encontradas entre los ríos estudiados. Posiblemente la influencia de las zonas de pantano también cobra un papel fundamental en este sentido. Es sumamente interesante la completa separación establecida para los ríos de Muertepungu. Es decir, se ve con facilidad que la escala espacial diferencia fuertemente a estos ríos del resto. Evidentemente esto implica diferencias con relación a clima, geología y posiblemente biogeografía.
A pesar de la existencia de un componente de intervención humana, la diferencia en la presencia de ciertos taxa entre cotas, superiores e inferiores a 3500 m, es importante. La intervención encontrada probablemente nos impide determinar diferencias más específicas. Como se mencionó, hay muchos otros grupos que podrían estar definiendo tendencias importantes en la caracterización de los ecosistemas acuáticos de la zona. Sin embargo, su poca abundancia y su especificidad, impiden establecer patrones de distribución. Únicamente un estudio a largo plazo podría proveer de patrones de distribución más precisos, incluso con cálculos de probabilidad de presencia de taxa determinadas en condiciones abióticas específicas.
Los resultados obtenidos tienen sesgo en relación con el nivel de identificación alcanzado en este trabajo. La falta de información existente en nuestro medio, así como, la incapacidad de llegar a niveles identificación más finos son obstáculos que impiden tener una idea aproximada de la diversidad existente en la zona. Por ejemplo, dentro de este estudio se colectaron 25 especímenes de Plecóptera. Este es un grupo que siempre presenta poca abundancia. Sin embargo, Stark (2001) reconoce la existencia de 41 especies de Plecópteros para el Ecuador, de las cuales 25 son nuevas para la ciencia. Estas descripciones se basan en especímenes colectados muchos años atrás y mantenidos en las colecciones de los museos National Museum of Natural History, Washington DC (USNM). Carnegie Museum of Natural History, Pittsburg, PA (CMNH) y en el de Unerversity of Missouri, Colunmbia (UM). Es sorprendente descubrir que prácticamente cada lugar en los que fueron colectados los especímenes aportó con una nueva especie. Igualmente puede ocurrir con el orden Ephemeroptera. Según Pescador et al. (2001), están registradas 375 especies para América del Sur, de los cuales 80% son endémicas. Además se cita a Perú como el tercer país con relación a riqueza encontrada, haciéndose notar que este puesto seguramente tiene relación con esfuerzos de colección diferenciales. En este sentido, es muy probable que Ecuador sea mega-diverso respecto a este grupo y simplemente no lo sabemos.
Grado de Intervención de Ecosistemas
Acuáticos
Dentro del presente estudio, se trató, en lo posible, de realizar los muestreos en lugares prístinos o con baja intervención. Si se encontraba algún tipo de impacto, se hacía lo posible por tomar muestras en zonas no expuestas. Sin embargo, es interesante enumerar, en general, los tipos de intervención encontrados (Tabla VI). En la zona de estudio se encuentran represas, carreteras y ganadería e intervención, relacionadas directamente con la población de Oyacachi.
Es interesante mencionar que dentro de todos los análisis realizados, (estadísticos, índices matemáticos y biológicos) los ríos intervenidos se distinguen del resto. En este sentido, aunque en este estudio no se hayan podido definir patrones específicos de caracterización de los ecosistemas acuáticos, sí se han podido determinar ríos con intervención.
Los resultados del índice ASPT demuestran que estos ríos no presentan un grado de intervención muy alto, relacionándolos con los presentados por Vásconez (2000). Al final de este análisis utilizando los resultados de los índices matemáticos, Fisher, H' y J', y del los índices biológicos, ASPI y EPT, se pudo distinguir ríos con calificaciones pobres. Estos son el río 13 (Cluster 16, Cota 3700 msnm) y los ríos 2, 3, 8 y IN (Cluster 16, Cota 3300 msnm).
Tanto los ríos 8 y 13 son de orden superior, por lo que son sujetos a la influencia de todas las cuencas que drenan. Como se observa, sus puntuaciones son bajas (Tabla V). Los dos ríos presentan un enriquecimiento en sus aguas, que puede ser el resultado de la presencia de fuentes de aguas minerales en su cuenca de drenaje. En la cuenca alta del río 8 se observó directamente una de estas fuentes y, a la distancia, otras dos posibles. En el río 13 no se tuvo esta suerte. Sin embargo, teniendo en cuenta la cercanía del río 10, es decir, suponiendo que hay un componente geológico en la zona que enriquece a estos ríos, el enriquecimiento evidente del río 13 debe tener un componente extra que puede ser una fuente de aguas minerales. Por esto la importancia de tener en cuenta este factor para futuros estudios.
Por otro lado, los ríos 2, 3, IN y 8 tienen la directa influencia de la población de Oyacachi. Como se establece en la Tabla VI, el río 2 tiene influencia de pastoreo, el río (punto) 3 un represamiento aguas río arriba y la influencia de gente a su alrededor. El río (punto) IN, 470 m aguas abajo del punto 3, a más de las influencias establecidas para el punto 3, atraviesa la parte occidental de la población de Oyacachi, teniendo una influencia directa de la central hidroeléctrica y de las piscinas de truchas existentes en la población. El río 8 está rodeado de campos de pastoreo.
Variables para nueva caracterización
abiótica
Ratificando el estudio de Vásconez et al. (2002), la altitud es la variable eje de toda la validación, relacionándose directamente con factores como temperatura y saturación de oxígeno e indirectamente con pH, caudal, velocidad de corriente, entre otras. Sin embargo, el rango utilizado en Vásconez et al. (2002) parece ser amplio para predecir diferencias en las características de los ecosistemas en el área de estudio.
También se determinan tendencias que pondrían a Geología como una variable muy importante a tomar en cuenta en la zona de Oyacachi. Dentro de esta variable, o como una variable independiente, se deben tener en cuenta los puntos de afloramiento de aguas minerales y su influencia en determinadas cuencas.
Además, es fundamental, caracterizar a los ríos con relación al orden al que pertenecen, así como relacionarlos directamente con su área de drenaje. Es decir, detallar las influencias presentes en el área de drenaje. Por un lado, establecer la superficie drenada en el punto de muestreo. Por otro, establecer influencias en relación con pantanos, lagunas y tipo de vegetación. A pesar de que el trabajo de Vásconez et al. (2002) tiene un componente muy fuerte con relación a vegetación, carece del detalle suficiente que permita establecer esta relación para cuencas específicas. Una mejor caracterización podría basarse, por ejemplo, en las diferencias establecidas por Báez et al. (1999) y Valencia et al. (1999), con relación a páramo herbáceo y páramo húmedo (pantanos) y a la diferencia de vegetación en ciertas cuencas, como la presencia de bosque montano o bosques de páramo Báez et al. (1999).
Tomando en cuenta la complejidad de relaciones encontradas dentro del área de estudio, la variable más importante a tener en cuenta es intervención. En este esquema, se deben definir los tipos de intervención humana y, si es posible, el grado de ésta. De esta forma, se puede trabajar en problemas concretos con relación al manejo y conservación de ecosistemas acuáticos.
Agradecimientos 
Este trabajo ha sido posible gracias al generoso aporte de la oficina de la Agencia para el Desarrollo Internacional de los Estados Unidos, donación No. EDG-A-00-01-00023-00, a través del Programa Ecuador de The Nature Conservancy (TNC) junto al Proyecto Parques en Peligro (PeP). Tenemos mucha gratitud por el apoyo que continuamente nos brinda la gente del Programa Ecuador de TNC, en especial a S. Benítez y P. Arroyo.
Agradecemos a EcoCiencia, en especial a F. Cuesta y a G. Remache, por su apoyo en logística y en la generación de mapas. A Fundación Antisana, G. Mosquera y A. Ruiz, por su apoyo tanto en la negociación con la Asociación Pecuaria Santa Rosa de Muertpungu como en logística. A la Universidad San Francisco de Quito (USFQ), en especial al Dr. G. Reck (ECOLAP, Instituto de Ecología Aplicada), a los Doctores H. Valdebenito y a P. Riera (Colegio de Ciencias de la Vida), por todo su apoyo en la utilización del espacio físico, de los equipos y materiales de la USFQ. Al Herbario QCA, de la Pontificia Universidad Católica del Ecuador (PUCE), en especial a H. Navarrete, por permitirnos utilizar las colecciones del herbario y equipo.
Agradecemos también a K. Podvin, M. O. Borja y S. Ordóñez (USFQ), así como a G. Proaño (PUCE), por su ayuda en la limpieza, separación e identificación de macroinvertebrados. Nuestro reconocimiento y agradecimiento a C. Carrasco, en otras circunstancias coautora de este trabajo, por todo el esfuerzo paciente y eficiente que ha volcado en este estudio.
Referencias 
Allan, J. F. 1996. Stream ecology: Structure and function of running waters. Ed. Chapman & Hall, Great Britain.
Báez, S.; F. Cuesta & M. Peralvo. 1999. Caracterización vegetal de la cuenca alta del Río Oyacachi, Reserva Ecológica Cayambe-Coca. EcoCiencia, Quito, Ecuador.
Cuesta, F.; M. Peralvo & F. Van Manen. 2003. Andean bear habitat use in the Oyacachi River basin, Ecuador. Ursus 14: 00-00. "in press".
Centro para la Investigación de la Diversidad Cultural y Biológica de los Bosques Pluviales Andinos (DIVA). 2000. Oyacachi - La gente y la biodiversidad. Dinamarca y Ediciones Abya Yala, Ecuador. Primera Edición en español.
Fernández, H.R. & E. Domínguez. 2001. Guía para la determinación de los artrópodos bentónicos sudamericanos. Facultad de Ciencias Naturales e Instituto M. Lillo, Universidad Nacional de Tucumán, Argentina.
Fundación Antisana (FUNAN). 1999. Estudio biofísico, socioeconómico y de alternativas de manejo del sector "Flujo de lava de Antisanilla". Proyecto Biorreserva del Cóndor. Quito, Ecuador.
Hare, J. & P. Ramsay. 2001. Aquatic invertebrate communities of Ecuadorian waterfall pools: The effect of altitude and associated variables. in: Ramsay, P. (ed.) Pp.193-200. The Ecology of Volcán Chiles: High altitude ecosystems on the Ecuador-Colombia border. Peble & Shell publications. Plymouth UK.
Hawkins, Ch.; R. Norris; J. Gerritsen; R. Hugues & S. Jackson et al. 2000. Evaluation of the use of landscape classifications for the prediction of freshwater biota: synthesis and recommendations. The North American Benthological Society. 19(3):541-556.
Higgins, J.; M. Lammert; M. Bryer; M. Dephilip & D. Grossman. 1998. Freshwater conservation in the great lakes basin: development and application of an aquatic community classification framework. The Nature Conservancy, Chicago IL, USA.
Jacobsen, D. & E. Terneus. 2001. Aquatic macrophytes in cool aseasonal and seasonal streams: a comparison between Ecuadorian highland and Danish lowland streams. Aquatic Botany 71:282-295.
Jacobsen, D. & A. Encalada. 1998. The macroinvertebrate fauna of Ecuadorian highland streams in the wet and dry season. Arch. Hydrobiol. (142) (1):53-70.
Jacobsen, D.; R. Schultz & A. Encalada. 1997. Structure and diversity of stream invertebrate assemblages: the influence of temperature with altitude and latitude. Freshwater biology 38:247-261.
Kent, M. & P. Coker. 1992. Vegetation description and analysis, a practical aproach. Belhaven. Press London, UK.
Legendre, P. & A. Vaudor. 1991. The R- package: Clustering analysis. Département de Sciences Biologiques, Université de Montréal, Montréal, Canadá.
Mangurran, A.E. 1988. Ecological diversity and its measurements. Ed. Chapman & Hall, Great Britain.
McCreary, N. 1991. Competition as a mechanism of submerged macrophyte community structure. Elseiver Science Publishers B. V., Amsterdam. Aquatic Botany 41:177-193.
Metcalfe, J.L. 1989. Biological Water quality assessment of running waters based on macroinvertebrate communities: History and present status in Europe. Environmental Pollution 60: 101-139.
Pescador, M.L.; M.D. Hubbard &. M.C. Zúñiga. 2001. The estatus of the taxonomy of the mayfly (Ephemeroptera) fauna of Southamerica. Pp. 37-42. in: E. Domínguez (ed.) Trends in Research in Ephemeroptera y Plecoptera. Kluwer Academics/Plenum Publishers, New York.
Prowse, G. 2001. The stream invertebrate communities of the Río Bobo, Volcán Chiles in: Ramsay, P. (ed.) Pp.185-192. The Ecology of Volcán Chiles: High altitude ecosystems on the Ecuador-Colombia border. Peble & shell publications. Plymouth UK.
Roldán, G. 1996. Guía para el estudio de los macroinvertebrados acuáticos del Departamento de Antioquia. Centro de Investigaciones, CIEN, Facultad de Ciencias Exactas y naturales, Universidad de Antioquia, Colombia.
Rosenzweig, M. L. 1995. Species diversity in space and time. Cambridge University Press. Great Britain.
Sauer, W. 1965. Geología del Ecuador. Talleres gráficos del Ministerio de Educación, Quito-Ecuador.
Sculthorpe, C. D. 1967. The biology of aquatic vascular plants. New York: St. Martin´s Press.
Stark, B. 2001. Records and descriptions of Anacroneuria form Ecuador (Plecoptera: Perlidae), Scopolia. Journal of the Slovenian Museum of Natural History, No 46, Nov 2001, Schwarz d.o.o, Ljubljana, Slovenia.
Steinitz_Kannan, M.; P. Colinvaux & R. Kannan. 1983. Limnological studies in Ecuador: a survey of chemical and physical properties of Ecuadorian Lakes. Hydrobiology 65:61-103.
Stryer, L. 1985. Bioquímica. 2da Ed., Ed. Reverté S.A. Madrid, España.
Ter Braak, C. J. & P. Smilauer. 1986. CANOCO Reference manual and user´s guide to canoco for windows. Wageningen: centre of biometry. Netherlands.
Terneus, E. 2002. Estructura y composición florística de las plantas acuáticas en 70 lagunas de páramo y dos lagunas interandinas del Ecuador. Tesis de Doctorado, Pontificia Universidad Católica del Ecuador. Quito, Ecuador.
Valencia, R.; C. Cerón; W. Palacios & R. Sierra. 1999. Los sistemas de clasificación de la vegetación propuestos para el Ecuador. pp:19-28. en: Sierra, R. (Ed.), Propuesta Preliminar de un Sistema de Clasificación de Vegetación para el Ecuador Continental. Proyecto INEFAN/GEF-BIRF y EcoCiencia. Quito, Ecuador.
Vannote, R. L.; W. Minishal; W. Cummins; J. Sedell & C. Cushing. 1980. The river continuum concept. Canad. J. Fish. Aquat. Sci. 37: 130-137.
Vásconez, J. J. 2000. Resistencia a la contaminación orgánica de macroinvertebrados bentónicos en ríos de altura y de tierras bajas en Ecuador. Tesis de Licenciatura. Departamento de Ciencias Biológicas. Facultad de Ciencias Exactas y Naturales. Pontificia Universidad Católica del Ecuador. Quito, Ecuador.
Vásconez, J.J.; G. Remache; F. Cuesta; E. Terneus; M. Peralvo & B. Ríos. 2002. Caracterización de ecosistemas acuáticos a través de variables abióticas de la vertiente oriental de la Reserva Ecológica Cayambe-Coca, Ecuador. Fundación AGUA, The Nature Conservancy, Fundación EcoCiencia. Quito, Ecuador.
Weaver, R. & S. Rundle. 2001. The influence of altitude on macroinvertebrate community assemblages in the Río Chilma and its tributaries, Volcán Chiles. in: Ramsay, P. (ed.) Pp.177-184. The Ecology of Volcán Chiles: High altitude ecosystems on the Ecuador-Colombia border. Peble & shell publications. Plymouth UK.