Resumen 
La floración a nivel de comunidad en el Yasuní presenta
tres etapas: Activa (de mediados de julio a diciembre); Intermedia
(de junio a comienzos de julio y de enero a la primera mitad de
febrero) y la Temporada de pocas flores (de la segunda mitad de
febrero a mayo). La floración activa tiene una relación
inversa con la presencia de lluvias. En esta temporada un alto número
de árboles y lianas florecen; esto sucede en forma alternada.
Los árboles más altos (>20 m) determinan la
intensidad en la floración del bosque, mientras que los
árboles medianos (10-20 m) presentan mayor diversidad. Los
tiempos florales de las especies de las zonas altas, son diferentes a
los de las pendientes y zonas bajas, donde la disponibilidad de
humedad juega un papel importante. Las especies relacionadas
presentan tiempos de floración sincrónica; el momento
en que las flores se abren, difiere en unos cuantos días u
horas, como estrategia para no competir por los polinizadores.
Palabras claves: Estacionalidad, Fenología, Flores,
Precipitación, Yasuní.
Abstract 
The
flowering at community level show three periods: Active (mid July to
December), Intermediate (June to beginning of July and from January
to the first half of February) and Low flowering (second half of
February to May). The active flowering period has an inverse relation
with rainfall. In this period are high numbers of trees and lianas in
flower, but in alternate form. The tallest trees (> 20 m)
determine the intensity in flowering time in the forest to produce
more flowerings structures, while; the medium canopy trees (10-20 m)
have mayor diversity. The flowering times in the plateaus are
different that slopes and valley because it have more stress by the
moisture viability. I found related species showed synchronous
flowering but the timing when the flowers open differs within a few
day u hours as a strategy to avoid pollinator competition.
Key words:
Flowers, phenology, rainfall, seasonality, Yasuní.
Introducción 
La floración es el inicio de una nueva etapa reproductiva en las planta; en la cual, una secuencia de cambios fisiológicos y morfológicos, trasforman un ápice vegetativo en un ápice reproductivo (Raven et al. 1999). Al analizar este proceso a nivel de comunidad, cada individuo funciona en coordinación con el ambiente. Estudios fenológicos realizados en bosques tropicales con estaciones marcadas, han demostrado que la producción de flores del bosque es controlada por los cambios en las condiciones climáticas que favorecen la germinación y el establecimiento de un nuevo individuo (Garwood 1983; Foster 1990; Wright 1996). Pero ¿Qué sucede en los bosques amazónicos que se caracterizan por no tener una estacionalidad marcada que restringa o sincronice los eventos reproductivos?
El presente estudio analiza la floración de un bosque no estacional de la Amazonía Ecuatoriana, evalúa el comportamiento de la floración a nivel de comunidad y explora su relación con los factores climáticos más importantes. Además compara los eventos de floración en diferentes formas de vida, en distintos estratos, y en diferentes niveles topográficos. Y por último verifica si existe sincronía en la floración de especies relacionadas.
Materiales y Métodos 
El presente estudio se realizó desde febrero del 2000 a marzo del 2001, dentro del Parque Nacional Yasuní, al nor oriente de la Amazonía Ecuatoriana. Esta área comprende un bosque húmedo, siempre verde, de tierras bajas (Sierra 1999), que según la clasificación Bio climática de Cañadas-Cruz (1983), se encuentra en la región Muy húmeda Tropical. La muestra de bosque tropical en donde se realizó este estudio fue una parcela de 50 ha, establecida en un bosque de tierra firme, por el Proyecto Dinámica de Bosque Yasuní (PDBY), a 00°38'S y 76°30'W. Los inventarios de árboles y arbustos con diámetro a la altura del pecho (DAP) 1cm, en dos héctareas de la parcela, muestran como las especies más comunes a Rinoria lindeniana, Matisia oblongifolia, Marmaroxylon basijugum, Iriartea deltoidea y Matisia malacocalyx (Romoleroux et al. 1997).
El clima de la región es cálido, húmedo sin estaciones marcadas. La precipitación media anual es de 2826 mm. Aunque se considera al clima de esta región como no estacional, existen meses que son más lluviosos que otros. Este es el caso de mayo y junio, donde el nivel de precipitación llega a los 400 mm mientras que los meses más secos corresponden a agosto y septiembre, cuando la cantidad de lluvias no supera los 200 mm. Por otro lado, la temperatura es relativamente constante, fluctúa entre los 24 y 26°C (Acosta - Solis 1977; Cañadas-Cruz 1983).
La parcela descansa sobre dos pequeñas elevaciones con inclinaciones tenues. En estas pendientes el suelo es rojizo y arcilloso debido al desprendimiento de la capa orgánica y de nutrientes que se produce por efectos de las lluvias. Los valles o quebradas entre las colinas constituyen la parte más baja de la parcela; éstas son típicas tierras aluviales grises y cafés, cruzadas por riachuelos permanentes.
Toma de datos
El presente trabajo se basó en la cuantificación de la floración de especies arbóreas y lianas, utilizando los parámetros establecidos por Newstrom et al. (1994), para la caracterización de la floración. Las estructuras florales se recolectaron en 200 trampas permanentes construidas con tubos de PVC que forman un marco cuadrado con cuatro patas a manera de una mesa. La cara superior constituye una malla plástica porosa, para permitir que el agua de las lluvias escurra fácilmente. Las trampas se ubicaron entre cuatro y diez metros del sendero hacia el bosque; y de esta manera se aseguró que, las trampas se encuentren suficientemente alejadas tanto del sendero como de la siguiente trampa.
La recolección de estructuras florales en las 200 trampas constituyó un censo; el mismo que podía durar de tres a cinco días dependiendo de las condiciones climáticas. En total se realizaron 28 censos, uno cada dos semanas. El material colectado de cada trampa se revisó y separó por especie, el mismo día, para evitar alteraciones en las estructuras florales. Luego de secarlo se clasificó según la colección de referencia del Proyecto de Plántulas y Semillas para facilitar futuras comparaciones.
En el análisis comparativo de los eventos de floración de árboles y lianas, y entre los diferentes estratos se utilizó el criterio de clasificación de Foster (Hubbell & Foster 1986), propuesto para estudiar la dinámica de los bosques en la Red de Parcelas de 50 ha establecidas por el Centro de Ciencias Forestales del Trópico. Esta clasificación, actualizada hasta diciembre del 2001, incluye las siguientes categorías: T.- Árboles del dosel, mayores a 20 metros; M.- Árboles de sub dosel, entre los 10 y 20 m; U.- Árboles de sotobosque que se encuentran entre los 4 y 10 m; S.- Árboles pequeños y arbustos de sotobosque que llegan hasta los cuatro metros; y V.- Lianas.
Análisis de los datos
La información obtenida se clasificó en dos categorías: Registros florales. - que indican la presencia de flores o botones de una especie en una determinada trampa; y Registros de cantidad o número de flores. - que constituye el valor aproximado de la cantidad de flores o botones de una especie. Este dato se utiliza para describir la intensidad o amplitud de la floración (Newstrom et al. 1994), y fue tomado como el valor entero del logaritmo de base 10, en una escala de cero a tres, por la dificultad de contar flores pequeñas y numerosas.
Las relaciones entre la floración y las variables ambientales (precipitación y temperatura) se exploraron a través de varias correlaciones lineales. Para determinar si existen diferencias en la floración según la estratificación del bosque y en diferentes hábitats, se utilizó el Diseño de Bloques Completos al Azar (DBCA) como modelo estadístico y Tukey como prueba complementaria (Fowler et al. 1998). La sincronía entre especies relacionadas fue observada comparando las épocas de floración de cada especie.
Resultados y Discusión 
La evaluación de la floración del bosque durante 14 meses abarcó 3916 registros florales, de los cuales el 80,7 % corresponde a flores y el 19,3% a botones, que representan a 68 familias y 703 especies. Fabaceae, la familia más abundante en el área de estudio, evidenció también la mayor cantidad de registros florales, seguida por Arecaceae, la cual no tiene una diversidad muy alta, pero incluye a Iriartea deltoidea, la especie más común del área de estudio. I. deltoidea, no sólo es una especie muy dominante, también presenta una floración extendida y fases fenológicas superpuestas, es decir un mismo individuo puede producir botones, flores y frutos al mismo tiempo.
Estacionalidad de la
Floración
La floración del bosque mostró marcadas diferencias a lo largo del tiempo de estudio. A mediados de diciembre se observó mayor diversidad de especies floreciendo, con flores de 114 especies distintas distribuidas en el 75% de las trampas. Mientras que, a mediados de mayo sólo 27 especies florecían, encontradas en menos de la cuarta parte de las trampas ([[Figura 1]]). Por otro lado la amplitud de la floración llegó a su máximo nivel durante la tercera semana del mes de septiembre con un número aproximado de 15300 estructuras florales recolectadas (Figura 2). El Análisis de estos datos determinó que la estacionalidad de la floración a nivel de comunidad presenta tres momentos: Floración Activa, Floración Intermedia y la Temporada de Pocas Flores.
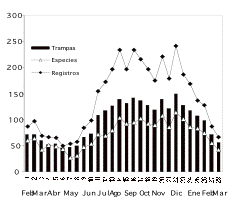
Figura 1. Cantidad
de registros florales, número de especies floreciendo y número
de trampas con al menos una estructura floral reportados en un bosque
de tierra firme de la amazonía ecuatoriana durante 14 meses de
estudio (28 censos), desde febrero del 2000 a marzo del 2001.
Figure 1. Registered flowers, number of species in flower and number of traps with at least one flower caught, reported from a terra firme forest in Amazonian Ecuador during 14 months (28 surveys) between February 2000 and march 2001.
Figure 1. Registered flowers, number of species in flower and number of traps with at least one flower caught, reported from a terra firme forest in Amazonian Ecuador during 14 months (28 surveys) between February 2000 and march 2001.
Floración activa: comprende a la acumulación de estadíos florales de diferentes especies, ya que el bosque florece con mayor intensidad y duración. Esta temporada inicia en julio y dura hasta mediados de enero. Incluso aquellas especies que presentaron flores durante todo el año, en algún momento de estos meses intensifican su floración; como son los casos de Eschweilera coriacea, Pouroma minor, Sorocea steinbachii y Virola elongata.
Floración intermedia: se presentan dos veces al año, antes de la temporada de floración activa durante en el mes de junio, cuando se nota claramente que la floración tiende a incrementarse. Entonces florecieron Aniba riparia, Trichilia adolfii, Inga bourgonii, Inga auristellae e Eriotheca globosa. Y después de la temporada de floración activa cuando los niveles de floración disminuyen, a finales de enero y se extiende durante todo febrero. Entre las especies que florecieron en este momento están: Bauhinia spp., Duroia hirsuta, Machaerium floribundum, Apeiba menbranacea, Dicranostyles holostyla y Cedrela fissilis.
La Temporada de Pocas Flores: es un tiempo de baja actividad floral, comprende marzo, abril y mayo. Entre las especies que florecen en estos meses se encuentran Matisia malacocalix, Sorocea steinbachii, Pseudolmedia laveis, Guarea gomma, Trichilia adolfii.
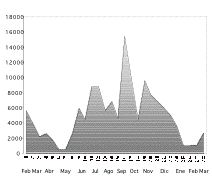
Figura 2. Número aprox. de
estructuras florales (amplitud de la floración) recolectadas
en 200 trampas, distribuidas en un bosque de tierra firme de
la Amazonía Ecuatoriana. Los números del 1 al 28
corresponden los censos o revisiones que se realizaron durante 14
meses, desde febrero del 2000 a marzo del 2001.
Figure 2. Approximate number of flowers collected in 200 traps reported from a terra firme forest in Amazonian Ecuador during 14 months (28 surveys) between February 2000 and March 2001.
Figure 2. Approximate number of flowers collected in 200 traps reported from a terra firme forest in Amazonian Ecuador during 14 months (28 surveys) between February 2000 and March 2001.
La floración y el
clima
Aunque aparentemente la caída de lluvias en el Parque Nacional Yasuní no presenta una estacionalidad marcada (meses inferiores a los 100 mm), los análisis realizados indican variaciones estacionales donde los meses más lluviosos pueden registrar hasta un 72% más de lluvias que el mes más seco. Esta variación en la precipitación determina la estacionalidad en los eventos de floración, de manera que muchas especies florecen cuando la cantidad de lluvias disminuye (Figura 3). Por otro lado, la temperatura, como factor individual, no es determinante en la floración, la correlación entre esta variable y la producción de flores no
mostró relación alguna, al mantener valores relativamente constantes durante todo el año ([[Tabla 1]]).
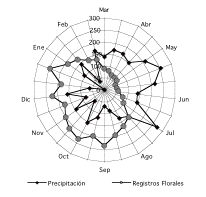
Figura 3. Relación
entre la precipitación y la cantidad de registros florales
durante 14 meses de un bosque de tierra firme en la Amazonía
Ecuatoriana, (desde el 2000 al 2001). Se uso promedios para los meses
que se repiten durante el tiempo de estudio (febrero y marzo). Los
valores numéricos expresan la cantidad de mm de lluvia y la
frecuencia de registros florales.
Figure 3. Relation between rainfall and flowers reported from a terra firme forest in Amazonian Ecuador during 14 months (28 surveys) between February 2000 and March 2001. Median used for the repeated months (February and march). Numerical values indicate rainfall in mm and lower number.
Figure 3. Relation between rainfall and flowers reported from a terra firme forest in Amazonian Ecuador during 14 months (28 surveys) between February 2000 and March 2001. Median used for the repeated months (February and march). Numerical values indicate rainfall in mm and lower number.
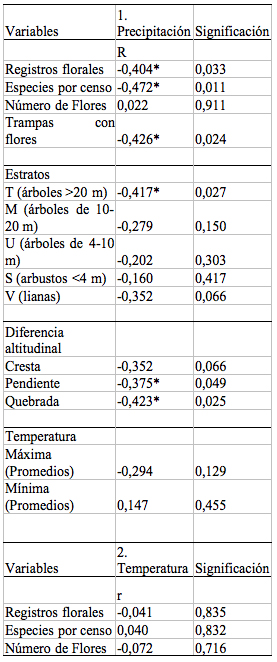
Tabla 1. Resultados
de la Correlación de Pearson (r) entre la floración de
un bosque de tierra firme en la Amazonía Ecuatoriana y las
variables ambientales registradas (precipitación y
temperatura). Las correlaciones se realizaron para las diferentes
variables en que se midió la floración, así como
también para cada estrato y nivel altitudinal.
Table 1. Pearson correlation (r) between flowering and registered environmental parameters (precipitation and temperature) reported from a terra firme forest in Amazonian Ecuador during 14 months (28 surveys) between February 2000 and march 2001. The correlations are made for different variables in flowering for every stratum and altitudinal level.
Table 1. Pearson correlation (r) between flowering and registered environmental parameters (precipitation and temperature) reported from a terra firme forest in Amazonian Ecuador during 14 months (28 surveys) between February 2000 and march 2001. The correlations are made for different variables in flowering for every stratum and altitudinal level.
Arboles y lianas,
estrategias distintas?
Tanto árboles como lianas produjeron mayor cantidad de flores, dentro de "la temporada de floración activa" (r = 0.548; p = 0.003), pero la floración no fue simultánea (Figura 4), las lianas florecieron cuando la mayoría de los árboles ya habían florecido o estaban por florecer (rs= -0.545; p = 0.044). Esto probablemente se debe a que las flores de estas dos formas de vida ocupan los mismos niveles en la estructura vertical del bosque, de tal forma que un comportamiento alternado en los tiempos de floración, evita la competencia por los polinizadores y posteriormente por los dispersores, cuando los frutos estén maduros.
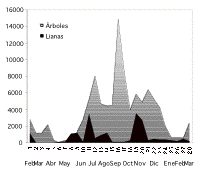
Figura
4. Cantidad de estructuras florales de árboles y lianas de un
bosque de tierra firme de la Amazonía Ecuatoriana, encontrados
en 28 censos o revisiones durante 14 meses, desde febrero del 2000 a
marzo del 2001.
Figure 4. Number of flowers on trees and lianas reported from a terra firme forest in Amazonian Ecuador during 14 months (28 surveys) between February 2000 and march 2001.
Figure 4. Number of flowers on trees and lianas reported from a terra firme forest in Amazonian Ecuador during 14 months (28 surveys) between February 2000 and march 2001.
La Floración en los diferentes
estrato
Los árboles grandes del dosel (T) y subdosel (M), producen más flores, y las diseminan a mayores distancias; por lo tanto, dominan el ciclo de floración del bosque. Además estas dos categorías son precisamente las que presentan mayor estacionalidad, ya que las condiciones, de luz y humedad, a las que pueden alcanzar los árboles altos a través del dosel son muy diferentes a las que se encuentran dentro del bosque Frankie (1974). En consecuencia, las especies responsables de los picos en las curvas de floración son Alchornea triplinervia, Virola duckei, Cedrelinga cateniformis, Otoba glycycarpa y Parkia multijuga.
La floración en
diferentes hábitats
La floración en las crestas de las colinas es diferente a la que se presenta en las pendientes y en las quebradas (F = 42.018; p = 0.000; CV= 4.82%). Lo que se debe a dos razones: primero; en la parte alta de las colinas, la densidad de árboles y la riqueza de especies es mayor a la de las partes bajas, razón por lo cual, el número de registros florales y de especies floreciendo es mayor. Y segundo; las especies florecen en respuesta a la disminución de la humedad de suelo. Cuando la cantidad de lluvias disminuye, los suelos de diferentes hábitats se secan proporcionalmente a la altura (Foster 1990). Es decir, la humedad del suelo en la cresta se escurre más rápido que en los otros dos niveles, lo que se evidencia en el valor de las correlaciones ([[Tabla 1]]).
Sincronía en la
Floración
A nivel de comunidad existe una floración sincrónica intra e interespecífica entre la mayoría de árboles, arbustos y lianas del bosque, los cuales florecen cuando la cantidad de lluvias disminuyen. Sin embargo al analizar con detalle los eventos de floración de cada especie se observó que las especies cercanas, del mismo género o familia, tienden a mantener sincronía en sus épocas de floración. Entre las ventajas de la floración sincrónica están la posibilidad de atraer a una mayor cantidad de polinizadores, aumentar el potencial de entrecruzamiento a nivel intraespecífico (Augspurger 1990) y conducir a un desarrollo sincrónico de que sacian a los predadores, que de otro modo destruirían la producción de semillas y la productividad del bosque (Garwood 1983). La asincronía en cambio, predispone a las plantas a recompensar ricamente a los polinizadores ya que impulsan a una clase de especialistas a regresar una y otra vez en busca de su alimento (Leigh 1990). Entre algunos ejemplos de sincronía están las especies de los Parkias, Ingas, Bauhinias, Guareas, etc. Estas involucran fases activas de floración dentro del espacio de tiempo correspondiente a la realización de los censos. Sin embargo, los tiempos de floración difieren en horas, días e incluso semanas. Estas diferencias concuerdan con la hipótesis del "polinizador compartido" (Wright & Calderón 1995) según la cual los tiempos de floración deben estar segregados para evitar la sobre posición de congéneres que tienen estructuras florales similares y por lo tanto, los mismos polinizadores.
Agradecimientos 
El presente trabajo fue posible gracias al Proyecto de Plántulas y Semillas (SSP) que auspició, financió y motivó esta investigación. A la Dra. Nancy Garwood, el Dr. Joseph Wright y Viveca Persson. Mi reconocimiento también al Dr. Renato Valencia, Gorki Villa y especialmente al Dr. Hugo Navarrete por la dirección de este trabajo. Por último, mis más sinceros agradecimientos al Sr. Milton Zambrano, la Estación Científica Yasuní y el Herbario QCA de la Pontificia Universidad Católica del Ecuador.
Referencias 
Acosta - Solis, M. 1977. Conferencias Fitogeográficas. Instituto Panamericano de Historia y Geografía. Quito, Ecuador.
Augspurger, K.C. 1990. Una Señal para la floración sincrónica. Pp. 201-218. En: E.G. Leigh, Rand, A.S. & D. Windsor, (eds.) Ecología de un Bosque Tropical. Smithsonian Tropical Research Institute, Panamá.
Cañadas - Cruz, L. 1983. El Mapa Bioclimático y Ecológico del Ecuador, MAG - PRONAREG. Quito, Ecuador.
Foster, R.B. 1990. Ciclo estacional de caída de Frutos en la Isla de Barro Colorado. Pp. 219-241. En: E.G. Leigh, A.S. Rand & D. Windsor (eds). Ecología de un Bosque Tropical. Smithsonian Tropical Research Institute, Panamá.
Fowler, J; L. Cohen & P. Jarvis. 1998. Practical Statistics for Field Biology. Copy Right - Wiley. England.
Frankie, G.W. 1974. Tropical plant phenology: Aplication for estudies en community ecology. Pp. 287-296. In: H. Lieth (ed.). Ecological Studies. Vol 18. Phenology and Seasonality modeling. Springer - Verlag. New York, U. S.A.
Garwood, N.C. 1983. Seed Germination in a Seasonal Tropical - Forest in Panama. A Conmunity Study. Ecological Monographs, 53(2):159-181.
Hubbell, S. & R. Foster. 1986. Communness and Rarety in a Neotropical Forest: Implication for Tropical Tree Conservation. Pp 205-231. In: M. Soulé (ed.). Conservation Biology. Sinauer Associates, Inc., Massachusetts, U.S.A.
Leigh, E.G. 1990. Introducción: La Selección Natural y los Ciclos del Bosque. Pp. 175-178. En: Leigh, E.G.; A.S. Rand & D. Windsor (eds.). Ecología de un Bosque Tropical. Smithsonian Tropical Research Institute, Panamá.
Newstrom, E.; G. Frankie; G. Baker & R. Colwell. 1994. Diversity of Long - term Flowering Patterns. Pp. 142-160. In: McDade, L.; K. Bawa; H. Hespenheide & G. Hartshorn (eds). La Selva, Ecology and Natural History of a Neotropical Rain Forest. University of Chicago Prees, Ltd. U.S.A.
Raven, P; R.F. Everte & S. Eichhorn. 1999. Biology of plants. W.H. Freeman and Company worth publishers. New York, U.S.A.
Romoleroux, K; R. Valencia; R. Condit; H. Balslev & E. Losos. 1997. Inventario de 2 hectáreas en Yasuní. Pp 189-216. En: Valencia, R. & H. Balslev (eds.). Estudios sobre la diversidad y Ecología de plantas. PUCE. Quito, Ecuador
Sierra, R. (ed.), 1999, Propuesta Preliminar de un Sistema de Clasificación de Vegetación para el Ecuador Continental. Proyecto INEFAN/GEF-BIRF y EcoCiencia. Quito, Ecuador.
Wright, S.J. & O. Calderón.1995. Phylogenetic constraints on tropical flowering phenologies. Journal of Ecology 83: 937-948.
Wright, S.J. 1996. Phenological Responses to Seasonality in tropical Forest Plants. Pp 440-461. In: Mulkey, S.S.; R.L. Chazdon & A.P. Smith (eds.).Tropical Forest Plant Ecophysiology. Chapman y Hall. New York, U.S.A.
Anexo 1.- Lista de
nombres científicos mencionados como ejemplos el un estudio de
la Floración a nivel de Comunidad de un Bosque de tierra Firme
en la Amazonía Ecuatoriana.
Annex 1. Scientific names mentioned as examples in this study from a terra firme forest in Amazonian Ecuador.
Annex 1. Scientific names mentioned as examples in this study from a terra firme forest in Amazonian Ecuador.