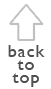Resumen 
La construcción del Oleoducto de Crudos Pesados (OCP) en el
Ecuador es una obra de infraestructura grande que puede tener un
impacto considerable sobre la vida silvestre. Por ello se realiza un
monitoreo de aves en un tramo en el noroccidente de Pichincha para
determinar la magnitud del impacto que pueda tener el OCP sobre la
avifauna. Aquí reportamos sobre algunos resultados
preliminares de este trabajo. Se emplearon conteos por punto en diez
puntos a lo largo de dos transectos de dos kilómetros de largo
en los sitios denominados Guarumos y El Campanario. Un análisis
de intervalos de confianza (95%) comparando las densidades relativas
en cada mes sugiere que si ha habido cambios en la avifauna. En
particular las aves frugívoras grandes y los insectívoros
terrestres han disminuido significativamente en las cercanías
del derecho de vía (DDV). Además las curvas de
acumulación de especies son más variables durante los
meses de la construcción, lo cual se debe a un cambio en la
utilización de hábitat y el comportamiento de las aves
cerca del DDV. Los resultados son algo difíciles de
interpretar debido al ruido generado por la maquinaria que no se
puede separar analíticamente del efecto de las aves. Un
seguimiento del monitoreo por dos años más va ayudar en
la interpretación de los datos obtenidos hasta la fecha.
Palabras clave: Impacto, Oil
pipeline, Avifauna, Ecuador
Abstract 
The
construction of the heavy crude pipeline (OCP) in Ecuador can have
great impacts on wildlife. Because of that a bird-monitoring project
is in place to determine the magnitude of the impact on birds in
northeastern province of Pichincha. Here we present preliminary
results from that research. We used point counts at ten points along
two 2 kilometer long transects at the Guarumos and El Campanario
sites. An analysis of 95% confidence intervals of relative abundances
in each month suggests that the construction did have an effect on
birds. In particular large frugivores and terrestrial insectivores
declined in abundances especially near the right of way (ROW).
Species accumulation curves are more variable during the construction
than before or after. This can be related to changes in habitat
utilization and behavior near the ROW. The data are, however,
difficult to interpret, as construction noise is a confounding
variable. Continuation of the project for two more years will help in
the interpretation of the short-term impact seen so far.
Key words: Impact, Oleoducto, Avifauna, Ecuador
Introducción 
Toda obra grande de infraestructura genera impactos en el ambiente. Los hábitats y la biodiversidad que éstos contienen se ven afectados en mayor o menor grado dependiendo del tipo de obra. Aproximadamente 14.5 km de la ruta del Oleoducto de Crudos Pesados (OCP) atraviesan el Área de Importancia para la Conservación de las Aves (AICA) del Noroccidente del Volcán Pichincha (Mindo). El AICA comprende aproximadamente 160.000 ha e incluye grandes extensiones del Bosque Protector Mindo-Nambillo y del Bosque Protector de la Cuenca Alta del Río Guayllabamba. Estos bosques acogen gran parte de la biodiversidad de la región e incluyen gran variedad de hábitats que van desde bosque subtropical del Chocó hasta bosque nublado y páramo. Esta área contiene más de 400 especies de aves, incluyendo 30 especies endémicas, cinco especies amenazadas y siete especies casi amenazadas (basado en Ridgely y Greenfield 2001).
La construcción de un oleoducto en un área boscoso puede afectar a la avifauna de diferentes maneras: 1) Para la colocación de la tubería se debe abrir una trocha de 7 a 9 m de ancho (Derecho de Vía, DDV) donde se desbroza toda la vegetación existente. En la mayoría de tramos además se ocupa una franja boscosa de hasta cinco metros para la acumulación del "top soil". Una vez terminados los trabajos de construcción, el área del DDV es revegetada únicamente con especies herbáceas y arbustivas. Este proceso inicialmente resulta en la pérdida total de hábitat para las especies de bosque sobre el DDV. Después de la revegetación quedará un corredor abierto con una estructura vegetal simplificada. 2) Con la tala de árboles sobre el DDV se abre un borde generando así el llamado "efecto de borde", es decir que los parámetros biofísicos, tales como humedad y temperatura cambian dentro de una distancia desconocida desde el borde (Foreman & Godron 1986). Usualmente el ambiente cerca del borde se vuelve más seco, un cambio que muchas especies no pueden tolerar. 3) La presencia humana y de la maquinaria pueden ahuyentar a las aves que por el estímulo visual desconocido, fenómeno al cual se ha llamado "neofobia" (Greenberg 1990). 4) El ruido de la construcción por la maquinaria pesada, motosierras y otros equipos puede alterar el comportamiento de las aves, las mismas que huyen del alboroto (Canaday & Rivadeneira 2001). El efecto del ruido muchas veces no se puede separar del efecto visual anteriormente mencionado. 5) El DDV puede convertirse en una vía de acceso para cazadores que afectan sobretodo las especies de gran tamaño (Thiollay 1999).
El objetivo del presente estudio es de determinar la magnitud del impacto que tiene la construcción sobre la avifauna poniendo especial interés sobre las especies amenazadas y endémicas en los sitios críticos identificados mediante la Evaluación Ecológica Rápida de la Ruta Norte Propuesta para el Paso del Oleoducto de Crudos Pesados, preparado por el Grupo de trabajo de Mindo. Por lo tanto se realizó el monitoreo antes, durante y después de la construcción del oleoducto. Aquí presentamos datos preliminares para mostrar que la construcción ha afectado a la avifauna.
Materiales y Métodos 
Área de
Estudio
El estudio se realiza en cinco sitios en el noroccidente de Pichincha; sin embargo, aquí solo presentamos datos preliminares para dos de ellos: Guarumos y El Campanario (aproximadamente entre 00°02-03'S y 78°39-40'W). Dentro de estas áreas se han determinado dos zonas de vida (según Holdridge 1967). En la parte baja de el Cerro El Campanario se encuentra a bosque muy húmedo montano bajo. La vegetación se caracteriza por la notable presencia de epífitas en las copas y troncos de los árboles.
En Guarumos y la parte alta de Cerro El Campanario la vegetación es típica para bosque muy húmedo montano. Esta formación vegetal se caracteriza por una alta incidencia de neblina y superávit de humedad. En esta zona de vida se puede observar árboles de poca altitud pero con la presencia de gran cantidad de epífitas, especialmente de musgos.
Conteo por
puntos
En cada sitio de monitoreo se estableció un transecto de dos kilómetros. A lo largo del transecto se ubicaron 10 puntos (a una distancia de 200 m cada uno, empezando a 100 m del inicio del transecto) en los cuales se realizaron los conteos. Cada transecto se visitó cada mañana (entre las 06h00 hasta las 09h30 aproximadamente) durante tres días.
A partir de noviembre (Guarumos) y diciembre (El Campanario) de 2002 se estableció un transecto control para cada uno de estos sitios. En los transectos control se establecieron cinco puntos de conteo que fueron muestreados durante tres días cada sitio en las mañanas (entre las 06h00 hasta las 07h30 aproximadamente). En ambos transectos, el primer y tercer día el recorrido empezaba desde un extremo del transecto y el segundo día desde el otro extremo.
Al llegar a cada estación, los investigadores debieron esperar dos minutos antes de empezar el conteo para minimizar el efecto de su llegada y ubicar las especies alrededor del punto. Durante los 10 minutos siguientes se registraron todas las especies de aves observadas y escuchadas en cada punto. El ornitólogo(a), asistido por un(a) asistente de campo, registró todas las aves que escuchó u observó en bandas de distancia de 0-10 metros, 10-25 metros, 50-100 metros y >100 metros. Cualquier ave volando sobre el área o llegando desde una distancia no detectada pero no se la incluida en el análisis de los datos.
Análisis
de datos
Los resultados obtenidos de los conteos por puntos han sido utilizados tanto para determinar el nivel de muestreo por sitio (curvas de acumulación) como para obtener densidades relativas de las poblaciones de aves en el área (tanto de forma general, como por gremios de interés; véase [[Tabla 1]]).
Curvas de
Acumulación
Las curvas de acumulación son utilizadas en ornitología para determinar el nivel de muestreo de cada sitio. Si la curva llega a estabilizarse en una línea horizontal significa que la avifauna ha sido muestreada adecuadamente. De igual manera si la línea sigue en ascenso, observaciones adicionales seguirán contribuyendo al descubrimiento de especies adicionales.
El análisis de las curvas de acumulación de especies, en conjunto con otros datos, puede contribuir a ampliar nuestros conocimientos sobre procesos biológicos que determinan la composición de la avifauna. Esto se debe a que la acumulación de especies depende de factores que afectan la detectabilidad, tales como la densidad de individuos, la territorialidad, tasas de movimiento y el estado reproductivo de las aves (por analogía con factores que determinan las tasas de capturas en redes de neblina; Remsen & Good 1996). Por lo tanto, la acumulación de especies va ser más rápida en áreas con una alta densidad de aves, en comunidades con especies territoriales, para aves activas que se mueven en áreas continuamente y durante la época reproductiva, cuando la actividad vocal es más alta. Por otro lado, una comunidad con bajas densidades de aves que incluye muchas especies con rangos grandes, de hábitos callados y fuera de la época reproductiva va exhibir curvas de acumulación menos pronunciadas y más lineares.
Densidades
Relativas Generales y por Gremios
Las densidades relativas se calcularon como promedio de individuos por punto. Se presenta las densidades relativas en gráficas que también incluyen intervalos de confianza del 95%. Los intervalos fueron obtenidos después de transformar los datos tomando la raíz del valor más uno para aproximar a una distribución normal. Luego de obtener los intervalos de confianza transformamos nuevamente los datos a su formato original. Los intervalos de confianza nos permiten decidir si las diferencias en las densidades relativas son estadísticamente significativas o no.
Se presenta los datos para dos áreas con radios diferentes: 25 metros y 100 metros alrededor de los puntos. El estándar es de 25 metros; sin embargo, las densidades de muchas especies con distribuciones agregadas (por ejemplo, aquellas especies que viven en grupos familiares o sociales) se subestiman ya que no se registran dentro de esta banda por razones aleatorias. Incrementar el área aumenta la probabilidad de detectar estas especies que muchas veces son muy comunes.
Resultados 
Conteo por
puntos: Curvas de acumulación
En un área total muestreado de 62.8 hectáreas en cada sitio se observaron 142 y 138 especies en El Campanario y Guarumos, respectivamente (Tabla I). Guarumos y El Campanario fueron muestreados adecuadamente ([[Figuras 1 y 2]]).
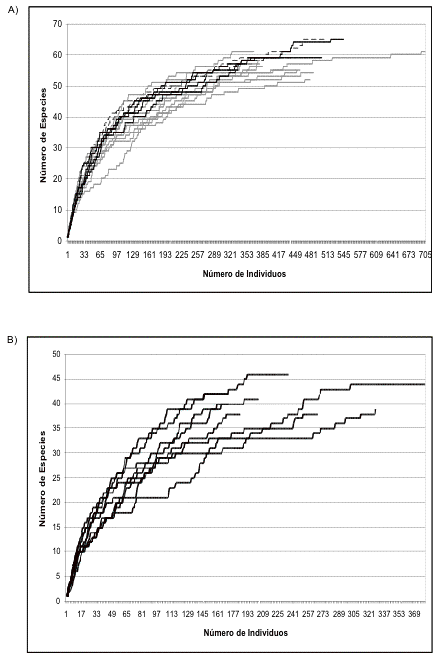
Figura 1. Curvas de acumulación de la avifauna
registrada en el transecto A) 1 (T1) y B) control (TC) de Guarumos a
lo largo del período de estudio.
Figure 1. Accumulation curves for the avifauna in transect A) 1 (T1) and B) control (TC) of Guarumos during the study period.
Figure 1. Accumulation curves for the avifauna in transect A) 1 (T1) and B) control (TC) of Guarumos during the study period.
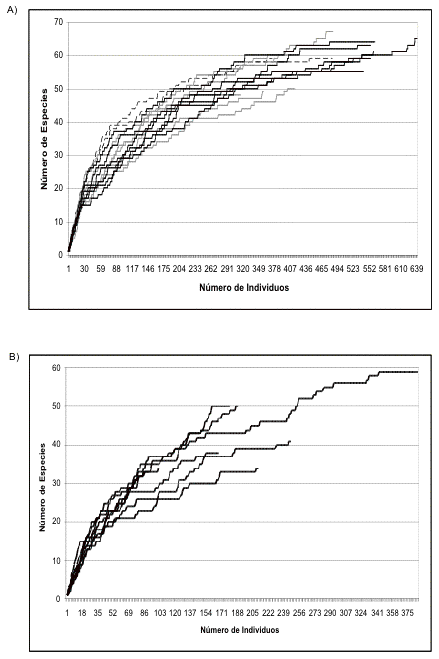
Figura 2. Curvas de acumulación de la avifauna
registrada en el transecto A) principal (T1) y B) control (TC) de El
Campanario a lo largo del período de estudio.
Figure 2. Accumulation curves for the avifauna in transect A) 1 (T1) and B) control (TC) of El Campanario during the study period.
Figure 2. Accumulation curves for the avifauna in transect A) 1 (T1) and B) control (TC) of El Campanario during the study period.
Las curvas de acumulación de especies de los transectos control de Guarumos y El Campanario muestran que los meses con la mayor acumulación de especies son diciembre de 2002, abril, junio y julio de 2003 para El Campanario, y diciembre de 2002, febrero, mayo y julio de 2003 para Guarumos. Como demuestran las observaciones sobre la reproducción de aves ([[Figuras 3 y 4]]) los picos reproductivos ocurren durante estos meses. Sólo en febrero de 2003 en Guarumos no se da este patrón.
Figura 3. Registros de la actividad reproductiva
Guarumos a lo largo del período de estudio.
Figure 3. Reproductive activity of Guarumos during the study period.
Figure 3. Reproductive activity of Guarumos during the study period.
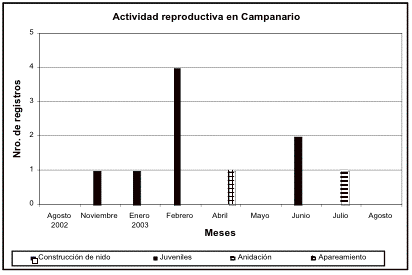
Figura 4. Registros de la actividad reproductiva en El
Campanario a lo largo del período de estudio.
Figure 4. Reproductive activity in El Campanario during the study period.
Figure 4. Reproductive activity in El Campanario during the study period.
Conteo por
puntos: Densidades Relativas con Intervalos de Confianza
Densidades Generales
Las densidades de la avifauna en general no fluctúan tan significativamente durante el período de estudio dentro de los 25 metros como lo observado en los 100 metros. En Guarumos y Campanario los patrones son similares pero, a pesar de la corta distancia entre los dos sitios (aproximadamente 500 metros), existen algunas diferencias notables. En Guarumos la densidad alcanza su nivel más bajo (estadísticamente significativo) en octubre de 2002. Nuevamente aumenta y alcanza otro clímax en diciembre del mismo año (Figura 5). En cambio en Campanario la densidad más baja se alcanzó en diciembre de 2002 con un incremento significativo en febrero de 2003, o sea con un atraso de dos meses con respecto a Guarumos (Figura 6).
El aumento en las densidades parece coincidir con la época reproductiva. Datos de comportamiento, observaciones de juveniles y signos de anidación muestran que los picos de densidades observados coinciden con la época reproductiva ([[Figuras 3 y 4]]).
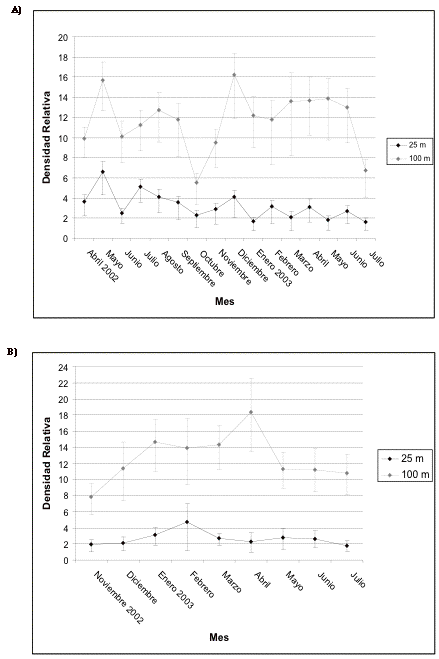
Figura 5. Intervalos de confianza de la avifauna en
general en A) transecto 1 y B) de control en Guarumos; para esta y
todas las gráficas que siguen la línea vertical marca
el inicio de la construcción.
Figure 5. Confidence intervals for the avifauna in general in A) transect 1 and B) control in Guarumos; For this and all following graphs the vertical line marks the start of construction.
Figure 5. Confidence intervals for the avifauna in general in A) transect 1 and B) control in Guarumos; For this and all following graphs the vertical line marks the start of construction.
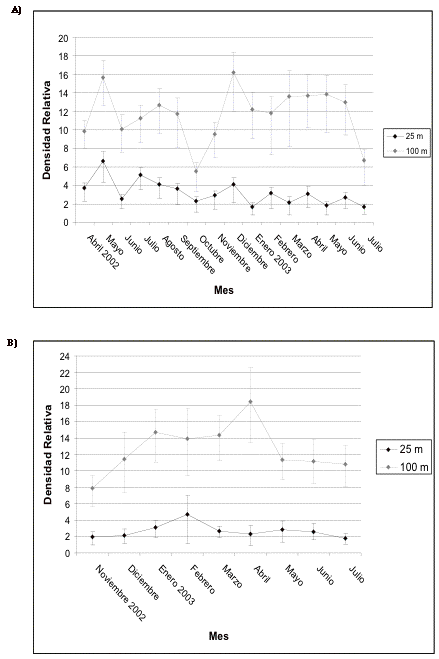
Figura 6. Intervalos de confianza de la avifauna en
general en A) transecto 1 y B) de control en El Campanario.
Figure 6. Confidence intervals for the avifauna in general in A) transect 1 and B) control in El Campanario.
Figure 6. Confidence intervals for the avifauna in general in A) transect 1 and B) control in El Campanario.
Densidades por
Gremios
Las especies de aves registradas fueron clasificadas dentro de 24 gremios de los cuales se analizó los más representativos. Aquí describimos en detalle los resultados para los gremios más importantes.
Frugívoros
grandes
En Guarumos este gremio presenta una importante inestabilidad en sus densidades, evidenciándose valores máximos en agosto y diciembre de 2002 y los puntos más bajos en noviembre de 2002 y junio de 2003. En el transecto control se destacan dos picos importantes en abril y junio de 2003, mientras que en el transecto 1 durante estos meses las densidades presentan los valores más bajos (Figura 7). En cambio, en Campanario el punto más alto se evidencia antes de la construcción, después de ésta se registra una disminución en las densidades hasta alcanzar el nivel más bajo en febrero de 2003. Posteriormente, las densidades vuelven a incrementarse, pero no alcanzan los valores registrados inicialmente. En el transecto control las densidades permanecen bajas pero se recuperan paulatinamente hasta alcanzar el pico más alto en agosto de 2003, lo cual coincide con el incremento registrado en el transecto 1 en el mismo mes (Figura 8).
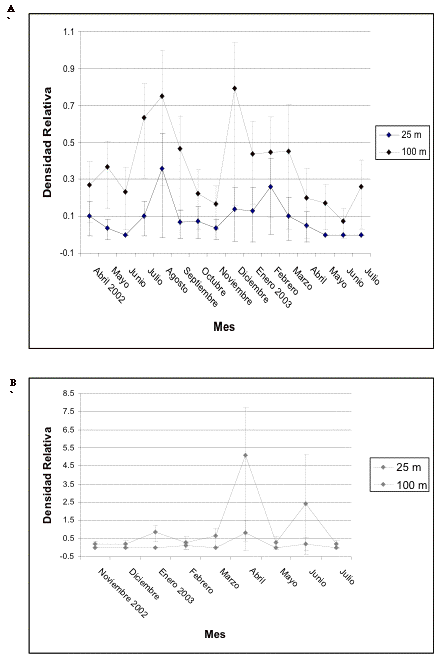
Figura 7. Intervalos de confianza de los frugívoros
grandes en A) transecto 1 y B) de control en Guarumos.
Figure 7. Confidence intervals for the large frugivores in A) transect 1 and B) control in Guarumos.
Figure 7. Confidence intervals for the large frugivores in A) transect 1 and B) control in Guarumos.
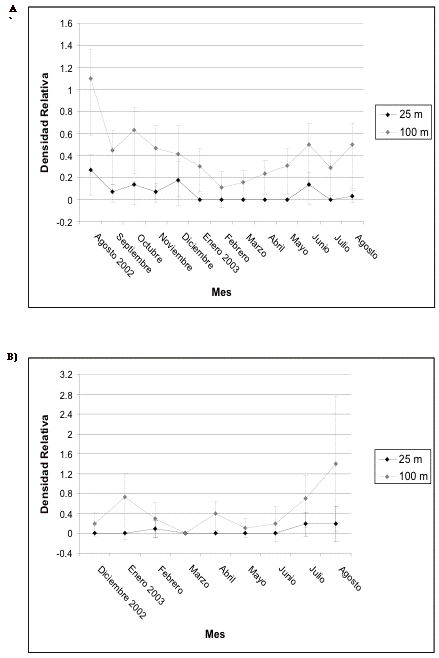
Figura 8. Intervalos de confianza de los frugívoros
grandes en A) transecto 1 y B) de control en El Campanario.
Figure 8. Confidence intervals for the large frugivores in A) transect 1 and B) control in El Campanario.
Figure 8. Confidence intervals for the large frugivores in A) transect 1 and B) control in El Campanario.
Frugívoros
medianos
En Guarumos se registra gran inestabilidad en las densidades a lo largo del período de estudio, con un pico importante en marzo de 2003. En el transecto control de Guarumos se registra el pico más alto en diciembre de 2002 dentro de los 100 metros, lo que coincide con lo registrado en el transecto 1, mientras que dentro de los 25 metros durante ese mes y enero de 2003 se evidencian los niveles más bajos (Figura 9). A diferencia de Guarumos, en Campanario las densidades son más estables dentro de las dos bandas y en los dos transectos. Es importante destacar que el valor más alto dentro de los 100 metros se evidencia en febrero de 2003 en el transecto 1 y en marzo del mismo año en el de control (Figura 10).
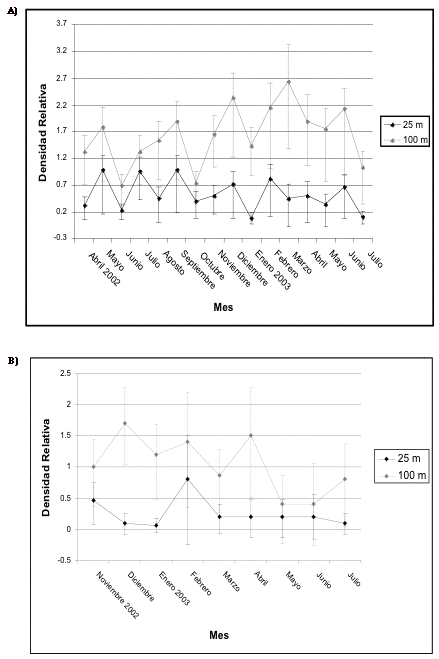
Figura 9. Intervalos de confianza de los frugívoros
medianos en A) transecto 1 y B) de control en Guarumos.
Figure 9. Confidence intervals for the median frugivores in A) transect 1 and B) control in Guarumos.
Figure 9. Confidence intervals for the median frugivores in A) transect 1 and B) control in Guarumos.
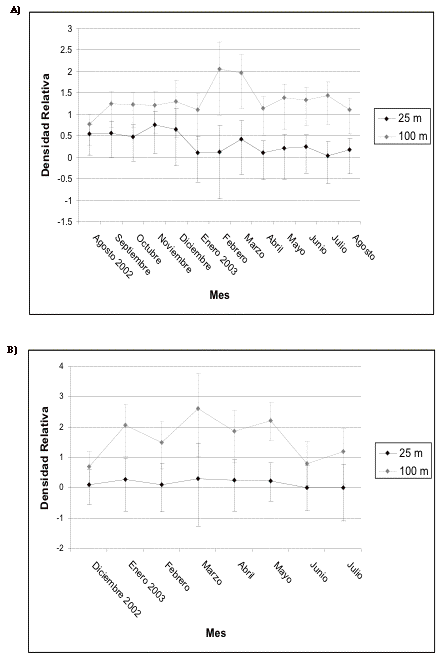
Figura 10.Intervalos de confianza de los frugívoros
medianos en A) transecto 1 y B) de control en El Campanario.
Figure 10. Confidence intervals for the median frugivores in A) transect 1 and B) control in El Campanario.
Figure 10. Confidence intervals for the median frugivores in A) transect 1 and B) control in El Campanario.
Frugívoros
pequeños
En Guarumos este gremio presenta el mismo patrón en sus densidades que el registrado para los frugívoros medianos; sin embargo, su punto más alto, además del registrado en marzo de 2003, ocurre en diciembre de 2002. En el transecto control se registra el valor más alto en enero de 2003 dentro de las dos bandas, lo que difiere con lo observado en el transecto 1 donde las densidades en este mes se presentan bajas (Figura 11).
En Campanario las densidades se presentan inestables, evidenciándose picos importantes en septiembre de 2002 (inicios de la construcción) y febrero de 2003 y un valor mínimo en noviembre de 2002. En el transecto control las dos bandas presentan la misma variación (inestabilidad), registrándose el pico más alto dentro de los 25 metros en febrero de 2003, mientras que en los 100 metros ocurre en mayo del mismo año (Figura 12).
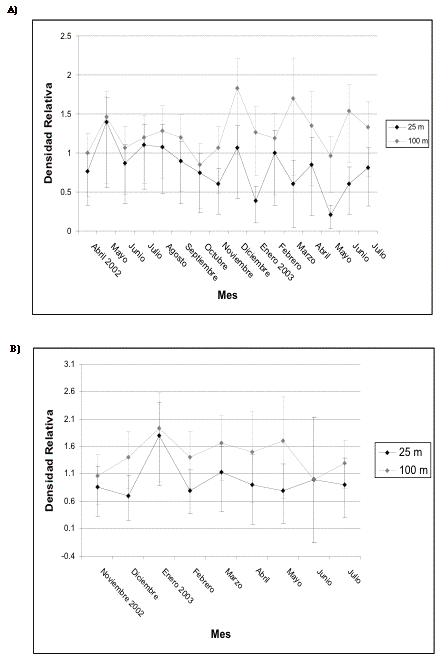
Figura 11.Intervalos de confianza de los frugívoros
pequeños en A) transecto 1 y B) de control en Guarumos.
Figure 11. Confidence intervals for the small frugivores in A) transect 1 and B) control in Guarumos.
Figure 11. Confidence intervals for the small frugivores in A) transect 1 and B) control in Guarumos.
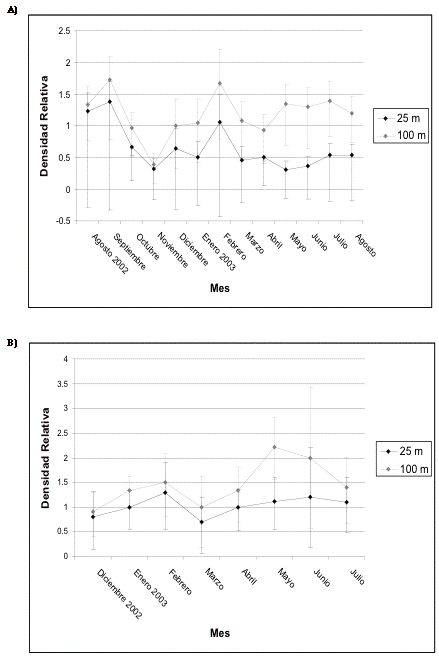
Figura 12.Intervalos de confianza de los frugívoros
pequeños en a) transecto 1 y B) de control en El Campanario.
Figure 12. Confidence intervals for the small frugivores in A) transect 1 and B) control in El Campanario.
Figure 12. Confidence intervals for the small frugivores in A) transect 1 and B) control in El Campanario.
Insectívoros
pequeños de sotobosque hoja
En Guarumos se evidencia una importante inestabilidad en las densidades de este gremio al inicio de la construcción, registrándose el pico más alto en mayo de 2003 y el más bajo en octubre de 2002, este último coincide con el patrón observado para la avifauna en general. En el transecto control se observa un incremento en las densidades desde el inicio del estudio hasta llegar a su valor máximo en abril de 2003 ([[Figura 13]]). En Campanario las densidades se ven más afectadas dentro de los 25 metros, en donde además del pico inicial antes de la construcción, sólo presenta otro incremento importante en febrero de 2003 (época reproductiva), lo cual también coincide con lo observado para la avifauna en general. Un patrón similar se registra dentro de los 100 metros. Al igual que en el transecto 1, en el de control, las densidades empiezan a recuperarse en enero de 2003 y, luego de experimentar un descenso en mayo, alcanzan su valor máximo en junio de 2003 (Figura 14).
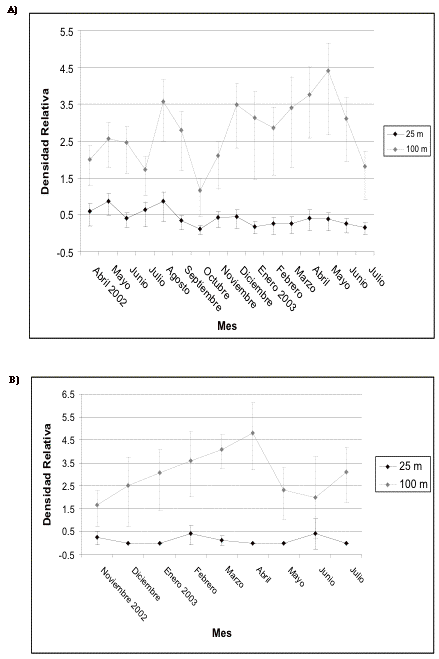
Figura 13. Intervalos de confianza de los frugívoros
pequeños en a) transecto 1 y B) de control en Guarumos.
Figure 13. Confidence intervals for the small insectivores in the understorey in A) transect 1 and B) control in Guarumos.
Figure 13. Confidence intervals for the small insectivores in the understorey in A) transect 1 and B) control in Guarumos.
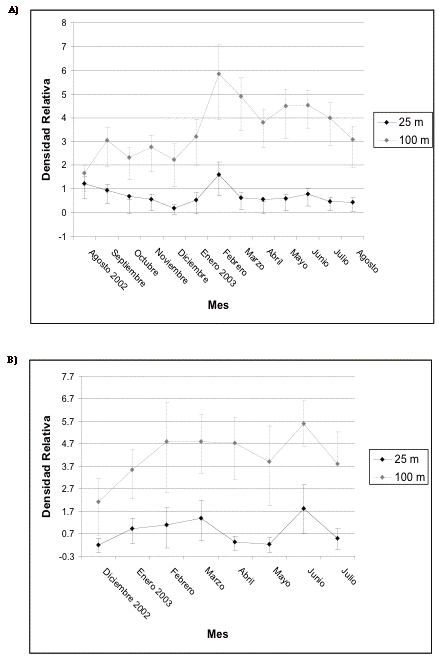
Figura 14. Intervalos de confianza de los insectívoros
pequeños de sotobosque hoja en A) transecto 1 y B) de control
en El Campanario.
Figure 14. Confidence intervals for the small insectivores in the understorey in A) transect 1 and B) control in El Campanario.
Figure 14. Confidence intervals for the small insectivores in the understorey in A) transect 1 and B) control in El Campanario.
Insectívoros
terrestres
En Guarumos las densidades se muestran también inestables (en los dos transectos), registrándose el pico más alto en mayo de 2002 (antes de la construcción) y el valor más bajo en julio de 2003. En el transecto control, el pico más alto se lo registra en enero de 2003, mientras que el mes siguiente le corresponde el valor más bajo (Figura 15). En Campanario este gremio presenta un incremento en las densidades durante los tres primeros meses de construcción; sin embargo, estos valores caen en enero y abril de 2003, pero no alcanzan los valores registrados al inicio del estudio. En el transecto control las densidades dentro de los 25 metros no se muestran tan inestables como en los 100 metros donde alcanza su valor máximo en febrero de 2003 (Figura 16).
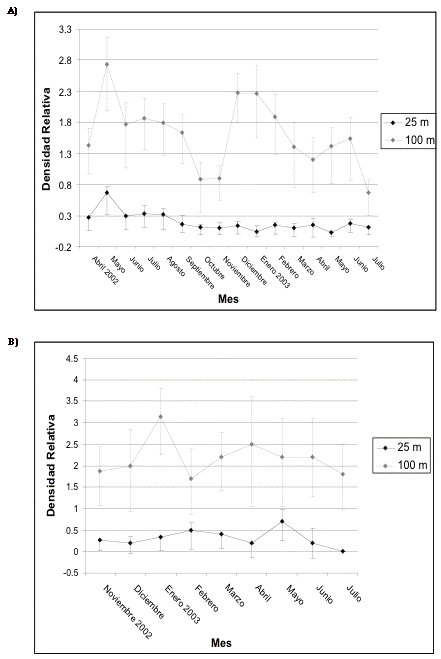
Figura 15. Intervalos de confianza de los insectívoros
terrestres en A) transecto 1 y B) de control en Guarumos.
Figure 15. Confidence intervals for the small terrestrial insectivores in the understorey in A) transect 1 and B) control in Guarumos.
Figure 15. Confidence intervals for the small terrestrial insectivores in the understorey in A) transect 1 and B) control in Guarumos.
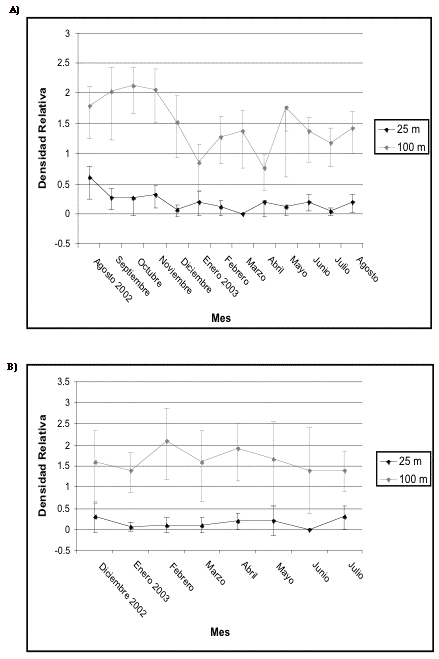
Figura 16.Intervalos de confianza de los insectívoros
terrestres en A) transecto 1 y B) de control en El Campanario.
Figure 16. Confidence intervals for the small terrestrial insectivores in the understorey in A) transect 1 and B) control in El Campanario.
Figure 16. Confidence intervals for the small terrestrial insectivores in the understorey in A) transect 1 and B) control in El Campanario.
Discusión 
Curvas de
Acumulación
Las curvas durante la actividad constructiva tienden a ser más variables que en períodos de calma. Este patrón se debe a un cambio de comportamiento de las aves. Muchas aves fueron desplazadas por la construcción pero todavía utilizan el área cerca del DDV para alimentarse. La actividad de forrajeo es menor durante los días de alta actividad por el hecho que se ahuyentan frente a los estimulos auditivos y visuales. Los análisis de los gremios apoyan esta conclusión, en especial para las frugívoras grandes y las insectívoras terrestres.
En Guarumos en diciembre de 2002, tanto en las densidades relativas, como en las curvas de acumulación, se evidencian valores altos. En este mes el monitoreo se lo realizó durante las vacaciones de Navidad y por tanto se suspendieron los trabajos de construcción (ausencia de ruido), lo que permitió que la detectabilidad de las especies de aves fuera mayor.
Densidades
relativas
Los patrones observados en los cambios de densidades para toda la avifauna se deben en gran parte a las épocas reproductivas. Las densidades más altas coinciden con observaciones sobre la actividad reproductiva.
Las diferencias observadas entre las abundancias relativas de Guarumos y El Campanario son interesantes ya que los dos sitios son muy cercanos. El pico de abundancias en El Campanario ocurre un mes después de Guarumos. El hecho de que no existe una gradiente altitudinal de gran magnitud entre los dos sitios, permite generar la hipótesis que la diferencia más importante entre los dos sitios es el inicio y la intensidad de la construcción. La construcción en El Campanario empezó en el cenit de la época reproductiva, posiblemente causando una reducción en el éxito reproductivo de muchas especies. La mayoría de especies realizan un nuevo intento de anidación, demorando por lo tanto el inicio de la siguiente época reproductiva.
Los patrones observados en los cambios de densidades para los diferentes gremios son más complejos y se pueden deber potencialmente a uno o más factores como: período reproductivo, inicio e intensidad de la construcción, disponibilidad de recursos, cambios microclimáticos, especialización ecológica y tamaño de cuerpo de las aves (ver más adelante). Además tiene un efecto importante el número de puntos muestreados, ya que no necesariamente se pudieron muestrear todos los puntos en cada ocasión. Cuando la actividad constructiva se encontraba al máximo, varios puntos no pudieron muestrearse por completo por razones de seguridad y por el ruido producido por las maquinarias.
En Guarumos se observa un efecto inmediato luego del inicio de la construcción, reflejado en la disminución de las densidades en todos los gremios. En este sitio los trabajos de construcción han sido constantes e intensos, especialmente los primeros meses de construcción, cuando las densidades de algunos gremios (frugívoros, insectívoros de vuelo corto bosque, omnívoros de sotobosque e insectívoros pequeños de dosel hoja) presentan más variabilidad. Aparte de la inestabilidad, las densidades en estos meses son bajas. Sin embargo, a pesar de esto la mayoría de gremios recuperan los valores iniciales especialmente en los meses cuando disminuyen las actividades constructivas y se produce un evento reproductivo.
Cabe mencionar que algunos gremios (insectívoros terrestres, frugívoros pequeños, insectívoros pequeños de sotobosque hoja, omnívoros de sotobosque e insectívoros pequeños de dosel hoja) a pesar de experimentar un incremento de sus densidades en los 100 metros, sufren una disminución de las mismas en los 25 metros. Este patrón se ha observado repetidamente durante todo el monitoreo. La pérdida de hábitat inicial y los trabajos de construcción obligan al desplazamiento de los individuos con territorios en el DDV y áreas cercanas, razón por la cual se observa un incremento de las densidades en la banda de los 100 metros. Por otro lado las densidades bajas y no recuperadas de estos gremios indican que son los más afectados por la construcción en este sitio. Además, el aumento de las densidades en la banda de los 100 m, indica que los efectos observados sobre las densidades de las aves se deben a la construcción y no a una disminución en la detectabilidad de las aves ya que son las aves más alejadas que se escucharían con menor frecuencia.
En Campanario algunos gremios, como frugívoros grandes, pequeños, insectívoros de tronco e insectívoros de vuelo corto bosque, muestran una disminución en sus densidades una vez iniciados los trabajos de construcción. De éstos, solamente los frugívoros grandes no recuperan los valores iniciales. Por otro lado los demás gremios aunque no muestran una disminución inmediata, si mantienen niveles bajos durante los primeros meses de la construcción (frugívoros medianos, insectívoros pequeños sotobosque hoja, insectívoros de vuelo corto área abierta y omnívoros de sotobosque), a excepción de los insectívoros pequeños de dosel hoja cuyas densidades aunque aumentan en los 100 metros, son inestables en los 25 metros y luego disminuyen. Otro caso son los insectívoros terrestres que de igual forma disminuyen en los 25 metros pero aumentan en los 100 metros, mostrando el patrón antes mencionado.
Después del análisis de cada sitio se ha observado una variación en los patrones de los diferentes gremios. Sin embargo existe consistencia en los patrones de aquellos usados como indicadores. Es así que los gremios de los insectívoros terrestres y frugívoros grandes se muestran como los más sensibles en casi todos los sitios, especialmente en la banda de los 25 m donde las densidades se mantienen bajas y no recuperan los valores iniciales.
Los insectívoros terrestres son de especial importancia ya que son considerados como indicadores debido a su dependencia de hábitats con presencia de bosque. Además, los insectívoros han demostrado ser altamente sensibles a los impactos humanos en otros estudios (Canaday 1997; Canaday & Rivadeneyra 2001; Thiollay 1999), siendo los más afectados en la primera fase de los procesos de deforestación y posterior efecto de borde.
La apertura de una vía en el medio del bosque se considera como un "gap" (área abierta dentro del bosque producida naturalmente por la caída de árboles) artificial grande que actúa como una barrera o un filtro para la dispersión, donde las especies de interior de bosque se ven renuentes de cruzar, a diferencia de "gaps" naturales (Thiollay 1999). Esta barrera afecta particularmente a los insectívoros terrestres, aves pequeñas de sotobosque, cuyas densidades dentro de los 25 metros son bajas. Inclusive se ha observado a frugívoros grandes llegar al borde del DDV y darse la vuelta sin cruzar.
Estos caminos también crean un efecto de borde interno, largo y abrupto. El efecto de borde implica cambios en las condiciones microclimáticas, en la estructura de la vegetación, favorece la invasión de especies que no son típicas de interior de bosque (p.e. Zonotrichia capensis y Phrygilus unicolor en Guarumos), e incrementa la tasas de depredación (Thiollay 1999). Los cambios microclimáticos actúan incrementando la cantidad de exposición solar en el suelo de áreas deforestadas y en los bordes. Estos cambios se ven acompañados con cambios en las poblaciones de aves insectívoras, ya que se ha visto que los insectos incrementan en abundancia y diversidad con la humedad. Debido a que los insectívoros presentan mayor especialización alimenticia que otros gremios, son entonces más sensibles a los cambios particulares de las poblaciones sobre las que ellos se alimentan (Canaday 1997).
Por otro lado, el aumento de luz solar en el área deforestada, favorece a algunas plantas en las primeras etapas de la sucesión, las mismas que producen abundantes frutos adecuados para los frugívoros de niveles bajos. Con esta referencia, esperamos que las abundancias de las aves frugívoras aumenten en el futuro, a medida que la vegetación se recupera. Sin embargo, los frugívoros grandes se pueden ver afectados por la falta de alimento y agujeros para anidar (Thiollay 1999). Este efecto es más severo en el área de estudio ya que árboles apropiados para la anidación tienden a caerse rápidamente debido a lo fuertes que son las pendientes del sector. Adicionalmente, la vulnerabilidad de los frugívoros puede estar en algunos casos también relacionada al tamaño del cuerpo. Los frugívoros grandes parecen ser más vulnerables debido a su restricción a hábitats específicos (Kattan el al. 1994)
También se ha evidenciado que los insectívoros y en especial los frugívoros declinan con la presión de cacería (Thiollay 1999). Aunque no existió observación directa de cacería por parte del equipo de campo de CECIA, sí hubieron comentarios de trabajadores sobre algunos casos en que los dueños de las propiedades (únicas personas que pudieron tener acceso al DDV) fueron encontrados cazando aves.
Posiblemente un buen porcentaje de los decrecimientos poblaciones en las primeras etapas de la construcción del OCP fueron debidos al ruido y a la presencia de gran cantidad de trabajadores. La respuesta al ruido es debida probablemente a neofobia, reacción innata de evitar estímulos nuevos (Greenberg 1990). Este efecto parece poder afectar particularmente a las frugívoras grandes que tienen densidades poblacionales relativamente pequeñas (Kattan 1992). Las cuchillas sin embargo, constituyen un sitio importante de caza para especies rapaces. Con la apertura del DDV está actividad se ve favorecida y la presencia de los frugívoros grandes podría ser mermada.
El ruido de la construcción interrumpe la comunicación, especialmente de un lado al otro del DDV, lo que estaría aislando a ciertas poblaciones acústicamente al interrumpir la atracción intraespecífica. El hecho que algunas especies prefieren las cuchillas para emitir sus cantos, ya que desde estos lugares tienen mayor difusión (Bohórquez & Stiles 2002) subraya la importancia de estos hábitats para la comunicación. Por lo tanto el ruido y la presencia de trabajadores estan favoreciendo el efecto de borde, impidiendo la dispersión de las especies.
[[Conclusiónes]]
En resumen, la respuesta de las aves a la alteración del bosque varía ampliamente entre grupos de especies o gremios. Estas respuestas pueden agruparse en: 1) especies que se ven favorecidas por las alteraciones humanas, incrementando sus números o extendiendo su distribución, 2) especies poco afectadas y 3) especies severamente afectadas. Según Thiollay (1999) el incremento de unas especies no compensa la disminución de otras. La pérdida de especies sensibles en la riqueza total de un sitio puede enmascarar la invasión de especies adaptadas a condiciones alteradas (Thiollay 1999), razón por la cual se aconseja realizar un análisis por gremios como el presentado en este estudio.
En el caso de la construcción del OCP en los transectos estudiados se han identificado algunos factores con sus respectivos efectos en la avifauna del sector. La continuación de este monitoreo por dos años más va permitir una evaluación de impacto más acertada.
Agradecimientos 
El Consorcio OCP Ecuador S.A. financió este estudio. El personal de Techint y OCP colaboraró logísticamente con el equipo de monitoreo. R. Williams contribuyó al proyecto en los primeros meses. Asistentes de campo que participaron fueron L. Navarrete, F. Rodas, A. Solano, E. Freire, E. Guevara, T. Ghía, S. Salazar, T. Sánchez, M. Cuichán, J. Aguirre, M. Cevallos, M. Yánez, K. Suntaxi y A. Lara, al igual que al L. Muñoz. Los monitores ambientales y ornitológicos B. Maiguashca, F. Cáceres e I. Castro, contribuyeron con observaciones, y T. Dávila aportó con especial dedicación. Neblina Forest a través de M. Durán y M. Díaz brindaron apoyo logístico. Todo el personal de CECIA, en especial su directora S. Loor-Vela, dieron su apoyo incondicional y brindaron todas las facilidades durante el proyecto.
Referencias 
BirdLife International. 2000. Threatened birds of the world. Lynx Editions y BirdLife International. Barcelona y Cambridge.
Bohórquez, C. & G. Stiles. 2002. The paradoxical social system of the Dusky Bush-Tanager (Clorospingus semifuscus): lekking in a nine-primaried oscine? Journal of Field Ornithology, 73(3):281-291.
Canaday, C. 1997. Loss of insectivorous birds along a gradient of human impact in Amazonia. Biological Conservation, 77:63-77.
Canaday, C. & J. Rivadeneyra. 2001. Initial effects of a petroleum operation on Amazonian birds: terrestrial insectivores retreat. Biodiversity and Conservation 10: 567-595.
Foreman, R.T. & M. Godron. 1986. Landscape ecology. J. Wiley and Sons, New York, New York, U.S.A.
Greenberg, R. 1990. Ecological plasticity, neophobia, and resource use in birds. En M. L. Morrison; C.; J. Ralph; J. Verner & J.R. Jehl Jr. (Eds.). Avian Foraging: Theory, Methodology, and Applications. Studies in Avian Biology 13, p431-437.
Kattan, G.H. 1992. Rarity and vulnerability: the birds of the Cordillera Central of Colombia. Conservation Biology, 6(1):64-70.
Kattan, G.; H. Alvarez-López & M. Giraldo. 1994. Forest fragmentation and bird extinctions: San Antonio eighty years later. Conservation Biology, 8: 138-146.
Remsen, J.V., and D. A. Good. 1996. Misuse of data from mist-net captures to assess relative abundance in bird populations. Auk, 113:381-398.
Thiollay, J.M. 1999. Responses of an avian community to rain forest degradation. Biodiversity and Conservation, 8:513-534.
Tabla 1. Lista de especies de aves registradas (x) en las cinco áreas críticamente sensibles de la IBA de Mindo; los gremios son granívoros (Gr), carroñeros (Cñ), carnívoros (Ca), insectívoros voladores (InV), insectívoros de vuelo corto en áreas abiertas (InVcA), insectívoros de vuelo corto en áreas abiertas (InVcB), insectívoros pequeños que se alimentan de insectos en hojas de sotobosque (InPSH), insectívoros pequeños que se alimentan de insectos en las hojas de docel, insectívoros medianos que se alimentan de insectos en las hojas (InMH), insectívoros terrestres (InT), insectívoros que se alimentan sobre troncos (InTr), insectívoro grande que se alimenta de insectos en hojas de docel (InGHD), frugívoras pequeñas (FrPe), frugívoras medianas (FrMe), frugívoras grandes (FrGr), nectarivoras Trochilidae de pico corto (NeTC), nectarívoras Trochilidae de pico largo (NeTL), nectarívoras Paserifomes (NeP), omnívoras de sotobosque (OmSo) y omnívoras de docel (OmDo).
Table 1. Species list of all registered birds (x) in the five areas sensitive to IBA in Mindo: The guilds are granivores (Gr), carroñeros (Cñ), carnivores (Ca), flying insectivorees (InV), insectivores with short flight in open areas (InVcA), insectivores with short flight in open areas (InVcB), ismall insectivores picking insects from leaves in the understorey (InPSH), small insectivores eating insects from canopy leaves and mid size insectivores picking insects from leaves (InMH), terrestrial insectivores (InT), insectivores feeding on trunks (InTr), large insectivores feeding on insects on canopy leaves (InGHD), frugívoras pequeñas (FrPe), frugívoras medianas (FrMe), large frugivores (FrGr), nectarivorous Trochilidae with short beako (NeTC), nectarivorous Trochilidae with large beak (NeTL), nectarivorous Paserifomes (NeP), understorey omnivores (OmSo) y canopy omnivores (OmDo).
| Nombre Científico | Gremio | Guarumos | El Campanario |
|
|
|
|
|
|
Nothocercus
julius |
Gr | x | x |
|
|
|
|
|
| Cathartes aura | Cñ |
|
x |
|
|
|
|
|
| Chondrohierax uncinatus | Ca |
|
x |
| Oroaetus isidori | Ca | x | x |
|
|
|
|
|
| Micrastur ruficollis | Ca | x | x |
| Micrastur semitorquatus | Ca | x | x |
|
|
|
|
|
| Penelope montagnii | FrGr | x | x |
| Aburria aburri | FrGr |
|
x |
| Chamaepetes goudotii | FrGr | x | x |
|
|
|
|
|
| Odontophorus melanonotus | Gr | x | x |
|
|
|
|
|
| Columba fasciata | FrGr | x | x |
| Columba plumbea | FrGr | x | x |
| Geotrygon frenata | FrGr | x | x |
|
|
|
|
|
| Bolborhynchus lineola | Gr | x | x |
| Pionus sordidus | FrGr | x | x |
| Pionus seniloides | FrGr | x | x |
| Amazona mercenaria | FrGr | x | x |
|
|
|
|
|
| Piaya cayana | InGDH |
|
x |
|
|
|
|
|
| Otus albogularis | Ca | x | x |
| Glaucidium jardinii | Ca | x | x |
| Strix virgata | Ca | x | x |
| Strix albitarsis | Ca | x | x |
|
|
|
|
|
| Lurocalis rufiventris | InV | x | x |
| Caprimulgus longirostris | InVcA | x |
|
| Uropsalis segmentata | InVcB | x | x |
|
|
|
|
|
| Streptoprocne zonaris | InV | x | x |
| Cypseloides rutilus | InV | x | x |
|
|
|
|
|
| Phaethornis syrmatophorus | NeTL | x | x |
| Doryfera ludovicae | NeTL | x | x |
| Colibri thalassinus | NeTL | x | x |
| Colibri coruscans | NeTL | x | x |
| Adelomyia melanogenys | NeTC | x | x |
| Heliodoxa rubinoides | NeTL | x |
|
| Coeligena torquata | NeTL | x | x |
| Coeligena lutetiae | NeTL | x |
|
| Ensifera ensifera | NeTL |
|
x |
| Boissonneaua flavescens | NeTC | x | x |
| Heliangelus strophianus | NeTC | x | x |
| Eriocnemis nigrivestis | NeTC | x |
|
| Ocreatus underwoodii | NeTC | x | x |
| Lesbia nuna | NeTC | x |
|
| Metallura tyrianthina | NeTC | x |
|
| Aglaiocercus kingi | NeTC | x |
|
| Chaetocercus mulsant | NeTC |
|
x |
|
|
|
|
|
| Pharomachrus antisianus | FrGr | x | x |
| Pharomachrus auriceps | FrGr | x | x |
| Trogon personatus | FrGr | x | x |
|
|
|
|
|
| Hapaloptila castanea | OmDo |
|
x |
|
|
|
|
|
| Semnornis ramphastinus | FrMe | x | x |
|
|
|
|
|
| Andigena laminirostris | FrGr | x | x |
|
|
|
|
|
| Piculus rivolii | InTr | x | x |
| Veniliornis nigriceps | InTr | x | x |
| Campephilus pollens | InTr | x | x |
|
|
|
|
|
| Synallaxis azarae | InPSH | x | x |
| Synallaxis unirufa | InPSH | x | x |
| Hellmayrea gularis | InPSH | x | x |
| Margarornis squamiger | InTr | x | x |
| Premnoplex brunnescens | InTr |
|
x |
| Pseudocolaptes boissonneautii | InTr | x | x |
| Syndactyla subalaris | InMH |
|
x |
| Thripadectes holostictus | InMH | x | x |
| Dendrocincla tyrannina | InTr | x | x |
| Xiphocolaptes promeropirhynchus | InTr | x | x |
| Lepidocolaptes lachrymiger | InTr | x | x |
|
|
|
|
|
| Drymophila caudata | InPDH | x | x |
|
|
|
|
|
| Grallaria squamigera | InT | x | x |
| Grallaria ruficapilla | InT | x | x |
| Grallaria nuchalis | InT | x | x |
| Grallaria rufula | InT | x | x |
|
|
|
|
|
| Myornis senilis | InT | x | x |
| Scytalopus unicolor | InT | x | x |
| Scytalopus spillmanni | InT | x | x |
| Acropternis orthonyx | InT | x | x |
|
|
|
|
|
| Phyllomyias nigrocapillus | InPDH | x | x |
| Phyllomyias cinereiceps | InPDH | x | x |
| Phyllomyias uropygialis | InPDH | x | x |
| Elaenia albiceps | FrPe | x |
|
| Mecocerculus poecilocercus | InPDH | x | x |
| Mionectes striaticollis | FrPe | x | x |
| Pseudotriccus ruficeps | InPSH | x | x |
| Poecilotriccus ruficeps | InPSH | x |
|
| Myiophobus flavicans | InVcB |
|
x |
| Pyrrhomyias cinnamomea | InVcA | x | x |
| Myiophobus pulcher | InVcB | x | x |
| Contopus fumigatus | InVcA | x | x |
|
Ochthoeca
fumicolor |
InVcA | x | x |
|
Ochthoeca
rufipectoralis |
InVcA | x | x |
|
Ochthoeca
cinnamomeiventris |
InVcB | x |
|
| Ochthoeca frontalis | InVcB | x | x |
| Ochthoeca diadema | InVcB | x | x |
| Myiotheretes striaticollis | InVcA | x |
|
| Myiotheretes fumigatus | InVcB | x | x |
| Myiodynastes chrysocephalus | InVcA |
|
x |
| Pachyramphus versicolor | InVcA | x | x |
|
Pachyramphus
homochrous |
InVcA |
|
x |
|
|
|
|
|
| Ampelion rubrocristatus | FrMe | x | x |
| Pipreola riefferii | FrMe | x | x |
| Pipreola arcuata | FrMe | x | x |
| Rupicola peruviana | FrGr |
|
x |
|
|
|
|
|
| Cyanolyca turcosa | OmDo | x | x |
| Vireo leucophrys | InPDH | x | x |
|
|
|
|
|
| Myadestes ralloides | FrMe | x | x |
| Catharus fuscater | FrMe | x | x |
| Turdus fuscater | OmSo | x | x |
| Turdus serranus | OmSo | x | x |
|
|
|
|
|
| Notiochelidon murina | InV | x | x |
| Notiochelidon cyanoleuca | InV | x | x |
|
|
|
|
|
|
Cinnycerthia
unirufa |
InPSH | x | x |
| Cinnycerthia olivascens | InPSH | x | x |
| Thryothorus euophrys | InPSH | x | x |
| Troglodytes solstitialis | InPDH | x | x |
| Henicorhina leucophrys | InPSH | x | x |
|
|
|
|
|
| Dendroica fusca | InPDH | x | x |
| Myioborus miniatus | InPDH | x | x |
| Myioborus melanocephalus | InPDH | x | x |
| Basileuterus tristriatus | InPSH | x | x |
| Basileuterus nigrocristatus | InPSH | x | x |
| Basileuterus coronatus | InPSH | x | x |
|
|
|
|
|
| Euphonia xanthogaster | FrPe | x | x |
| Chlorophonia pyrrhophrys | FrPe |
|
x |
|
Conirostrum
cinereum |
NeP | x |
|
|
Conirostrum
sitticolor |
NeP | x |
|
|
Conirostrum
albifrons |
NeP | x | x |
| Diglossopis cyanea | NeP | x | x |
|
Diglossa
lafresnayii |
NeP | x |
|
|
Diglossa
humeralis |
NeP |
|
x |
| Diglossa albilatera | NeP | x | x |
| Thlypopsis ornata | InPSH |
|
x |
| Pipraeidea melanonota | FrPe |
|
x |
| Tangara parzudakii | FrPe | x |
|
| Tangara labradorides | FrPe |
|
x |
| Tangara ruficervix | FrPe | x | x |
| Tangara nigroviridis | FrPe | x | x |
|
Tangara
vassorii |
FrPe | x | x |
|
Iridosornis
rufivertex |
FrPe | x | x |
| Anisognathus igniventris | FrMe | x | x |
| Anisognathus somptuosus | FrMe | x | x |
| Anisognathus notabilis | FrMe |
|
x |
|
Buthraupis
montana |
FrMe | x | x |
|
Dubusia
taeniata |
FrMe | x | x |
|
Thraupis
cyanocephala |
FrPe | x |
|
| Piranga rubriceps | FrMe |
|
x |
| Chlorospingus semifuscus | FrPe | x | x |
| Hemispingus atropileus | InPSH | x | x |
|
Hemispingus
superciliaris |
InPSH | x |
|
| Hemispingus ochraceus | InPSH | x | x |
| Chlorornis riefferii | FrMe | x | x |
| Catamblyrhynchus diadema | Gr | x | x |
|
|
|
|
|
| Pheucticus chrysogaster | Gr | x |
|
|
|
|
|
|
|
Catamenia
inornata |
Gr |
|
x |
| Haplospiza rustica | Gr | x |
|
|
Phrygilus
unicolor |
Gr | x | x |
| Atlapetes latinuchus | OmSo | x | x |
|
Atlapetes
tricolor |
OmSo | x | x |
|
Buarremon
brunneinucha |
OmSo | x | x |
| Buarremon torquatus | OmSo | x | x |
| Oreothraupis arremonops | OmSo | x | x |
| Zonotrichia capensis | OmA | x | x |
|
|
|
|
|
| Amblycercus holosericeus | OmDo |
|
x |
| Molothrus oryzivorus | OmDo | x | x |
| Psarocolius angustifrons | OmDo | x | x |
| TOTAL |
|
139 | 142 |